1型プロテインホスファターゼ (PP1) 複合体による生体膜形成の制御機構の一端を解明
- 発表者
-
中村 毅 (東京大学大学院農学生命科学研究科応用生命化学専攻 博士課程 学振特別研究員(DC2))
沼尻 祐未 (東京大学大学院農学生命科学研究科応用生命化学専攻 修士課程:当時)
奥村 祐哉 (東京大学大学院農学生命科学研究科応用生命化学専攻 博士課程:当時)
日高 純臣 (東京大学大学院農学生命科学研究科応用生命化学専攻 修士課程:当時)
田中 貴之 (東京大学大学院農学生命科学研究科応用生命化学専攻 博士課程:当時)
井上 一朗 (東京大学大学院農学生命科学研究科応用生命化学専攻 特任研究員)
須田 恭之 (筑波大学医学医療系 助教)
高橋 哲夫 (東海大学工学部生命科学科 准教授)
中西 秀樹 (中国・江南大学生物工程学院 教授)
高 暁冬 (中国・江南大学生物工程学院 教授)
Aaron M. Neiman (米国・ストーニーブルック大学 教授)
舘川 宏之 (東京大学大学院農学生命科学研究科応用生命科学専攻 准教授)
発表のポイント
◆細胞のモデルとして研究されている出芽酵母の、細胞分化・生体膜形成における1型プロテインホスファターゼ (PP1) 複合体 (注1)の新たな役割を明らかにしました。
◆出芽酵母の胞子形成時特異的なPP1 複合体が、調節サブユニットの複数の局在化シグナルを介してダイナミックに細胞内局在を変化させ、前胞子膜伸長に必須な役割を果たすことを示しました。
◆PP1 は真核生物で高度に保存されており、タンパク質のリン酸化/脱リン酸化を介した生体膜形成の制御の理解につながることが期待されます。
発表概要
出芽酵母は栄養飢餓に応答して胞子を形成します。この際、母細胞の中では輸送小胞の融合により前胞子膜と呼ばれる新たな生体膜が形成されます。前胞子膜はセプチン構造 (注2) とともにダイナミックな形態変化を経て成熟していくため、生体膜形成のモデルとして研究されています。この過程において、胞子形成時特異的な1型プロテインホスファターゼ (PP1) である Gip1–Glc7 複合体の機能が必須であることは知られていましたが、その詳細な分子機構は明らかになっていませんでした。
今回、東京大学大学院農学生命科学研究科の舘川宏之准教授らのグループは、PP1 複合体の調節サブユニットである Gip1 について解析を進め、胞子形成時における機能と前胞子膜やセプチン構造への局在化シグナルを明らかにしました。PP1 はヒトにも保存されているため、本研究はタンパク質のリン酸化/脱リン酸化を介した生体膜形成の制御の理解に寄与すると考えられます。
本研究は、MBoCハイライトとして掲載されており、アメリカ細胞生物学会のASCB Newsletter でも紹介されます。
発表内容
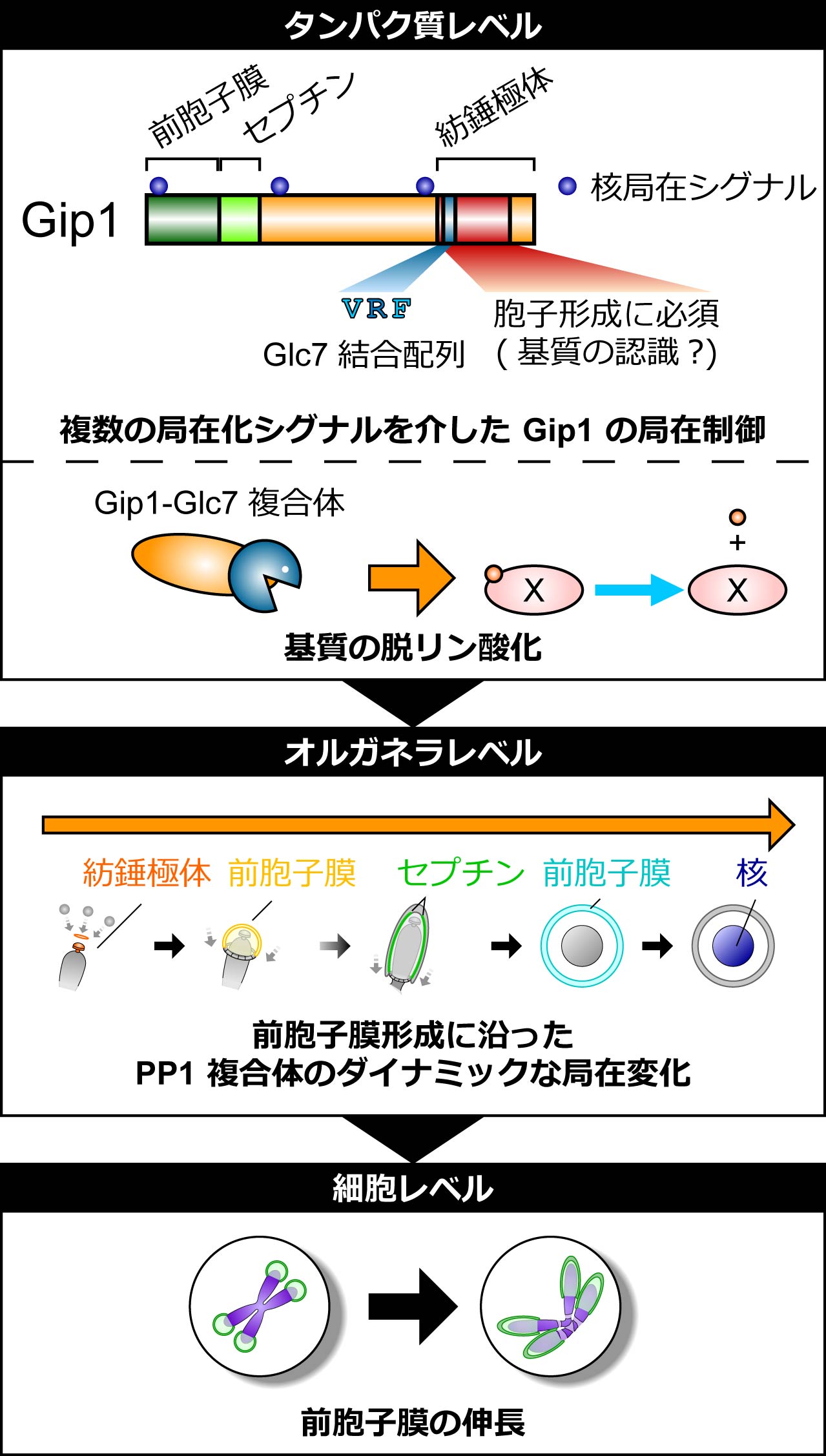
図1 PP1調節サブユニットGip1のドメイン構造、PP1複合体の細胞内局在と役割の模式図(拡大画像↗)
結果
研究グループは、前胞子膜の形態に着目し、gip1 破壊株の表現型を詳細に解析しました。gip1 破壊株で胞子形成を誘導すると、前胞子膜の形成は開始するものの小さな球状のまま留まっており、Gip1 は前胞子膜の楕円状への伸長に必要であることを見出しました。続いて、ライブイメージングにより Gip1 の局在を観察したところ、前胞子膜の形成過程にともない Gip1 は紡錘極体上に現れ、その後小さな前胞子膜からセプチン構造へ、さらに大きな前胞子膜から最終的には核へと、局在をダイナミックに変化させることを見出しました (図1中段)。
そこでGip1の局在変化と機能の分子基盤を明らかにするため、Gip1 の欠失変異体や点変異体を用いた解析を行った結果、以下に示す5点が明らかになりました (図1)。
1. N末端側には2つのα-ヘリックスからなる前胞子膜局在領域が存在し、この前胞子膜局在がGip1 の機能に必要である。
2. 前胞子膜局在領域に隣接したセプチン構造局在領域が存在する。
3. 複数の核局在シグナルを介して核に局在する。
4. C末端領域の VRF 配列を介して Glc7 と結合する。また、Glc7 との結合が Gip1 の機能に必要である。
5. C末端領域を介して紡錘極体に局在する。またこの領域が胞子形成に必要である。
これらの結果から、Gip1 の調節サブユニットとしての機能は、N末端領域を介した前胞子膜への局在とC末端領域を介した Glc7 との結合から構成されることが分かりました。そこで、局在化シグナルと胞子形成における機能が分離できるかを検討するために、別のタンパク質の前胞子膜局在シグナルを融合したキメラタンパク質を用いた実験を行いました。その結果、Glc7 と結合する VRF 配列を含む Gip1 のC末端領域が前胞子膜上に局在することが Gip1 の機能に十分であることを見出しました。さらに、Glc7を同様の手法で前胞子膜上に局在化させるだけではGip1の役割をバイパスできず、Gip1のC末端領域の共発現により初めてGip1の代わりをすることができることを示しました。これらの結果から、Gip1 は Glc7 と結合してその局在を制御するのみならず、そのC末端領域で脱リン酸化の基質認識にも関与することが示唆されました。
意義
本研究により、プロテインホスファターゼ複合体 (PP1) は、調節サブユニットによってその局在をダイナミックに制御し、生体膜の形態形成に寄与することが明らかになりました。今後、脱リン酸化の基質が明らかになることで、タンパク質のリン酸化/脱リン酸化を介した生体膜形成の制御メカニズムの理解に寄与すると考えられます。PP1 は酵母からヒトまで保存されており、細胞内の種々の機能に関与しています。新規生体膜形成はオルガネラ形成、精子形成、繊毛形成などでも見られる現象であり、これらの過程の制御機構の解明そして関連する疾患の理解にもつながることが期待されます。
発表雑誌
- 雑誌名
- ::「Molecular Biology of the Cell (米国細胞生物学会誌)」 Volume 28 (2017) 3881-3895
- 論文タイトル
- :Dynamic localization of a yeast development-specific PP1 complex during prospore membrane formation is dependent on multiple localization signals and complex formation
- 著者
- :Tsuyoshi S. Nakamura, Yumi Numajiri, Yuuya Okumura, Junji Hidaka, Takayuki Tanaka, Ichiro Inoue, Yasuyuki Suda, Tetsuo Takahashi, Hideki Nakanishi, Xiao-Dong Gao, Aaron M. Neiman, Hiroyuki Tachikawa*
- DOI番号
- :10.1091/mbc.E17-08-0521
- 論文URL
- :http://www.molbiolcell.org/content/28/26/3881.full
問い合わせ先
准教授 舘川 宏之 (たちかわ ひろゆき)
Tel:03-5841-5113
E-mail:atachi<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 1型プロテインホスファターゼ (PP1) 複合体
- 触媒サブユニットと調節サブユニットからなる複合体で、基質タンパク質を脱リン酸化する。出芽酵母では Glc7 が唯一の触媒サブユニットで、各種の調節サブユニットを介してさまざまな機能を担う。
- 注2 セプチン構造
- 酵母から高等動物まで保存された、低分子量GTP結合タンパク質からなる細胞骨格。出芽酵母においては、細胞分裂時の母・娘細胞間のくびれ部分のリング状構造や胞子形成時の前胞子膜に沿ったバー状構造として観察される。
- 注3 紡錘極体
- 出芽酵母の微小管形成中心で、動物細胞の中心体に相当する。核膜に埋め込また構造で、核内部と細胞質にそれぞれ露出する部分を持つ。胞子形成時には細胞質部分の構造が変化し、ポストゴルジ小胞の集合場所として機能する。