動物の成長や代謝調節を司るホルモン、インスリン様成長因子の細胞内情報伝達を
調節する新たな仕組みを解明
- 発表者
-
米山鷹介(東京大学大学院農学生命科学研究科 応用動物科学専攻・応用生命化学専攻 研究員)
Peter Lanzerstorfer(University of Applied Sciences Upper Austria 研究員)
丹羽英明(理化学研究所 ライフサイエンス技術基盤研究センター 上級技師)
梅原崇史(理化学研究所 ライフサイエンス技術基盤研究センター ユニットリーダー/科学技術振興機構 さきがけ研究者)
柴野卓志(東京大学大学院農学生命科学研究科 応用動物科学専攻・応用生命化学専攻 研究員(当時))
横山茂之(理化学研究所 横山構造生物学研究室 上席研究員)
千田和広(東京大学大学院農学生命科学研究科 応用動物科学専攻・応用生命化学専攻 教授)
Julian Weghuber(University of Applied Sciences Upper Austria 教授)
伯野史彦(東京大学大学院農学生命科学研究科 応用動物科学専攻・応用生命化学専攻 助教)
高橋伸一郎(東京大学大学院農学生命科学研究科 応用動物科学専攻・応用生命化学専攻 准教授)
発表のポイント
◆IGFの受容体(IGF-I受容体)の下流で働くIRS-1が、AP2というタンパク質複合体と結合することで、IGF-I受容体の活性持続性を調節するという新しい分子機構を解明しました。
◆IGFの細胞内情報伝達の異常によって引き起こされる、がんや代謝疾患などの疾病の発症機構の解明に役立つ可能性があります。
発表概要
今回、東京大学大学院農学生命科学研究科の高橋伸一郎准教授、伯野史彦助教らの研究グループは、IGF-I受容体の下流分子IRS-1が、IGF-I受容体の細胞膜から細胞内部への輸送(エンドサイトーシス)を制御する新規機能を有していることを見出しました。IRS-1がIGF-I受容体のエンドサイトーシスを促進するタンパク質複合体AP2と結合することで、IGF-I受容体がエンドサイトーシスされずに細胞膜上へ留まり、その結果、IGFシグナルが長期間維持されることを明らかにしました。今回の研究成果は、IGFシグナルの異常によって引き起こされる、がんや代謝疾患の発症機構の理解に貢献することが期待されます。
発表内容
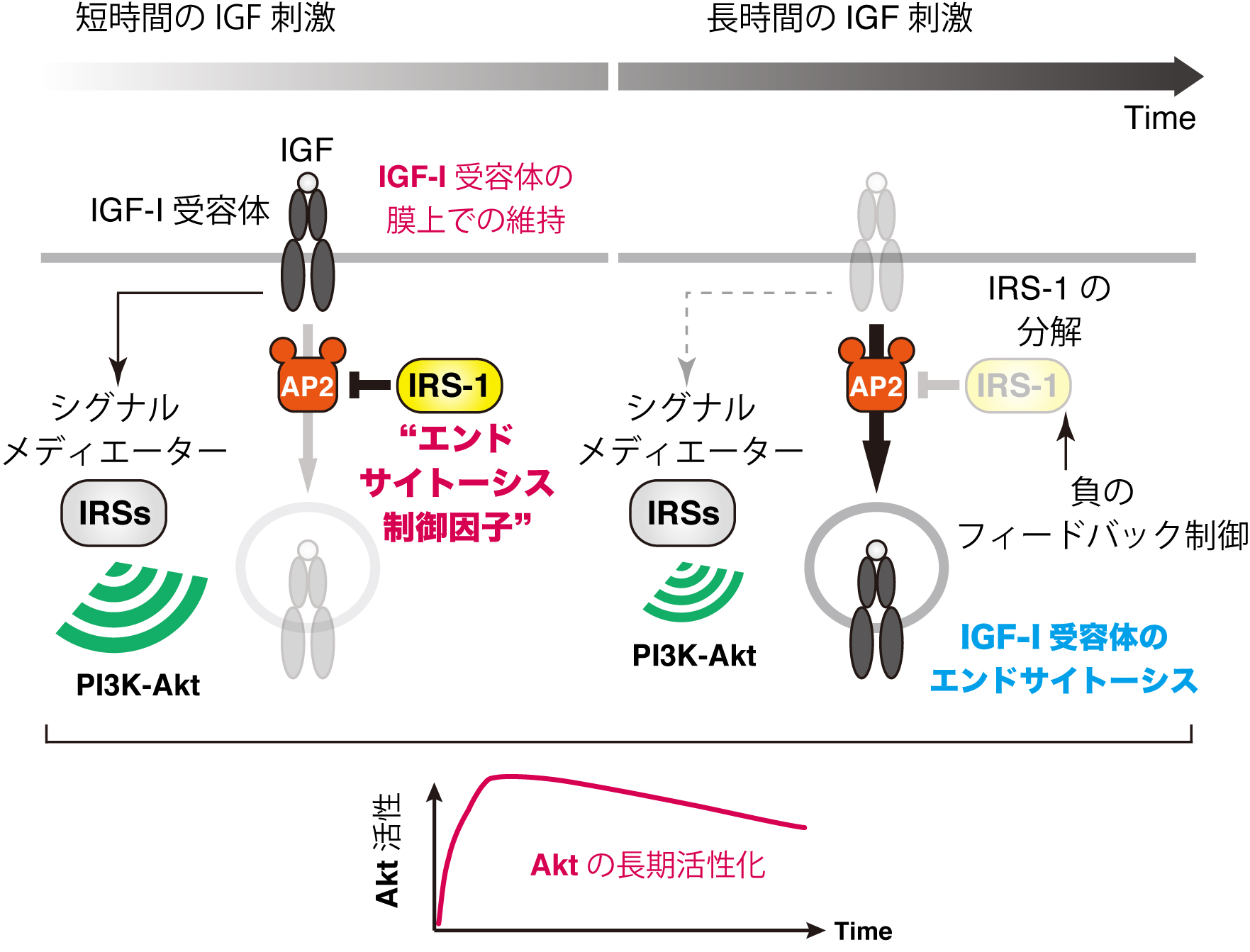
図1 今回の研究によって明らかとなったIGFの長期シグナル機構
IRS-1がAP2と結合することにより、活性化したIGF-I受容体のAP2依存的なエンドサイトーシスが阻害され、活性化状態のIGF-I受容体が細胞膜上へ維持される。IGFの長期刺激後、負のフィードバックシグナルによってIRS-1の分解が誘導されると、IGF-I受容体のエンドサイトーシスに対するブレーキが解除される形で、IGF-I受容体のAP2依存的なエンドサイトーシスが開始される。したがって、IGF-I受容体が長時間細胞膜上に留まるため、下流のPI3K-Aktk経路が長時間活性化するようになる。このように、IRS-1がシグナルメディエーターとしての機能とは独立して、IGF-I受容体のエンドサイトーシスを制御する機能を発揮することにより、IGFの長期シグナルが生成されると考えられる。 (拡大画像↗)
インスリン様成長因子(IGF)はインスリンと類似した構造をもつペプチドホルモンで、様々な細胞における増殖、生存、タンパク質をはじめとした様々な物質代謝の調節を担っています。IGFは細胞膜上の受容体(IGF-I受容体)に結合すると、受容体に内蔵されたチロシンキナーゼ(注1)が活性化され、これを引き金に細胞内へシグナルが伝達されます。活性化されたIGF-I受容体が、基質であるIRS(insulin receptor substrate; 注2)というタンパク質をリン酸化すると、リン酸化されたIRSにPI3K(phosphatidylinositol 3-kinase)が結合し、Akt経路というシグナル経路が活性化されます。これまでにIGF-I受容体はPI3K-Akt経路(注3)を持続的に活性化すること、そしてこの持続的な活性化が様々な細胞の増殖や神経細胞の生存、骨格筋のタンパク質代謝バランスの制御といったIGFの生理活性に必須であることが知られています。しかしながら、どのようにIGF-I受容体が持続的なシグナルを生み出しているのか、その分子機構は不明な点が多く残っています。本研究では、主要なIRSファミリー分子であるIRS-1に着目し、持続的なIGFシグナルが生成される細胞内機構の解明を目指しました。
これまでに、東京大学大学院農学生命科学研究科の高橋伸一郎准教授、伯野史彦助教らの研究グループは、IRS-1の機能が様々な相互作用分子によって調節されていることを明らかにしていました。今回、この研究グループはIRS-1と相互作用する分子としてAP2というタンパク質複合体を同定しました。AP2は、受容体などの細胞膜分子を細胞膜から細胞内部へ輸送する過程(エンドサイトーシス;注4)で働く分子です。AP2はクラスリンと呼ばれる被覆タンパク質と結合するとともに、積荷となるタンパク質と結合することで、エンドサイトーシスを促進します。IGF-I受容体をはじめとした膜受容体は一般に、活性化した後に細胞膜からエンドサイトーシスされ、細胞内部で分解されることが知られており、この過程はシグナル伝達を遮断するために使われています。詳細な生化学的な解析と細胞イメージング解析を行った結果、IRS-1がAP2に結合すると、IGFが結合した後に誘導されるIGF-I受容体のAP2/クラスリン依存的なエンドサイトーシスが阻害されることを見出しました。つまり、IRS-1がAP2の機能を阻害することで、IGF-I受容体が速やかにエンドサイトーシスされることなく、細胞膜上で活性を長時間維持できるという分子機構が稼働していることが判明しました(図1)。また、このIRS-1の機能は、従来知られていたIGF-I受容体の基質分子としての機能とは独立していることも明らかになりました。さらに、細胞にIGFを長時間処理すると、負のフィードバック制御(注5)によってIRS-1の分解が誘導されること、これによりIGF-I受容体のエンドサイトーシスに対するブレーキが外れることで、IGF-I受容体のエンドサイトーシスが開始されることも分かりました。IRS-1の発現量を低下させると、細胞がIGFを受容した後、速やかにIGF-I受容体がエンドサイトーシスされ、その結果、PI3K-Akt経路のシグナルが持続的から一過的になりました。そしてIGFによるタンパク質代謝関連の遺伝子発現制御が正常に起こらなくなりました。
以上のように、今回の研究によって、IRS-1が「IGF-I受容体のエンドサイトーシス制御分子」として機能すること、そしてこのIRS-1の機能がIGFの長期シグナルに極めて重要であることが分かりました。IGFの長期シグナルは成長や神経細胞の生存、タンパク質代謝のバランス制御といった様々な生理現象に関与していることから、今回発見したIRS-1によるIGF-I受容体のエンドサイトーシス制御はIGFの長期作用に共通して働く機構と考えられます。この研究成果は、IGF活性の異常によって引き起こされる、がんや代謝疾患などの疾病の発症機構の理解の一助となるとともに、疾病の新しい治療薬開発に役立つことが期待されます。
発表雑誌
- 雑誌名
- :eLife
- 論文タイトル
- :IRS-1 acts as an endocytic regulator of IGF-I receptor to facilitate sustained IGF signaling
- 著者
- :Yosuke Yoneyama, Peter Lanzerstorfer, Hideaki Niwa, Takashi Umehara, Takashi Shibano, Shigeyuki Yokoyama, Kazuhiro Chida, Julian Weghuber, Fumihiko Hakuno, Shin-Ichiro Takahashi
- DOI番号
- :10.7554/eLife.32893
- 論文URL
- :https://elifesciences.org/articles/32893
問い合わせ先
准教授 高橋 伸一郎(たかはし しんいちろう)
Tel:03-5841-1310
Fax:03-5841-1311
E-mail:atkshin<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 チロシンキナーゼ
- 標的タンパク質のチロシン残基にリン酸化を付加する酵素
- 注2 IRS(insulin receptor substrate)
- インスリン受容体やIGF-I受容体に内蔵されているチロシンキナーゼによってリン酸化されるタンパク質。IRS-1, 2, 3, 4の4つの分子種が知られており、いずれもリン酸化される多数のチロシン残基を持っていることが特徴である。IRSのリン酸化チロシン残基は様々なシグナル分子の結合部位として機能する。IRSのチロシンリン酸化は下流シグナル経路の活性化の起点と考えられている。
- 注3 PI3K-Akt経路
- 脂質のリン酸化酵素であるphosphatidylinositol(PI)3-kinase(PI3K)とタンパク質セリンスレオニンリン酸化酵素であるAktから構成されるシグナル経路。上流因子によって活性化したPI3Kは、膜に含まれる脂質PI4,5-二リン酸をリン酸化し、PI3,4,5-三リン酸を産生する。PI3,4,5-三リン酸を認識してAktが膜上へリクルートされる結果、Aktの活性化が誘導される。活性化されたAktは様々な基質をリン酸化することにより、細胞増殖・細胞生存や様々な代謝反応が制御される。
- 注4 エンドサイトーシス
- 細胞膜の陥入によって形成される小胞を介して、膜受容体をはじめとした細胞膜タンパク質を細胞内へ取り込み、分解される機構。小胞を被覆するタンパク質としてクラスリンを使う機構は、特にクラスリン依存性エンドサイトーシスと呼ばれる。
- 注5 負のフィードバック制御
- 一般に、ある系による得られた結果がその原因となったものを負に調節すること。インスリン/IGFシグナル経路においては、細胞が長時間インスリン/IGFにさらされると、PI3K-Akt経路からのシグナルがIRS-1へ伝わり、IRS-1が分解される。つまり、長時間のインスリン/IGF の 刺激後には、IRS-1を介したシグナル伝達が抑制される。