マラリア肝障害に関与する宿主因子の解明
- 発表者
-
溝渕 悠代(東京大学 大学院農学生命科学研究科 獣医学専攻 博士課程学生(当時))
藤井 渉(東京大学 大学院農学生命科学研究科 応用動物科学専攻 助教)
磯川 笙子(東京大学 大学院農学生命科学研究科 獣医学専修 学部生(当時))
石塚 幹菜(東京大学 大学院農学生命科学研究科 応用動物科学専攻 修士課程学生)
王 一涵(東京大学 大学院農学生命科学研究科 応用動物科学専攻 修士課程学生(当時))
渡辺 さよ子(東京大学 大学院農学生命科学研究科 応用動物科学専攻 修士課程学生(当時))
三條場 千寿(東京大学 大学院農学生命科学研究科 応用動物科学専攻 助教)
松本 芳嗣(東京大学 大学院農学生命科学研究科 応用動物科学専攻 教授)
後藤 康之(東京大学 大学院農学生命科学研究科 応用動物科学専攻 准教授)
発表のポイント
◆宿主免疫因子MRP14がマラリア肝障害を悪化させることを明らかにしました。
◆MRP14の阻害によるマラリア肝障害の新たな治療法開発が期待されます。
発表概要
重症マラリア(注1)の患者ではしばしば黄疸や血中肝酵素の上昇を伴う肝障害が見られますが、その病態発症機構については不明な点が多くありました。東京大学大学院農学生命科学研究科の溝渕悠代博士課程学生(当時)や後藤康之准教授らの研究グループは、宿主因子であるmyeloid-related protein 14(MRP14)がマラリアにおける肝障害の悪化に関与することを、ネズミマラリアモデルを用いて明らかにしました。
MRP14はマラリア原虫の感染によって血清中の濃度が上昇しますが、その上昇によりマクロファージ(Mφ:注2)の肝臓への集簇が増強されるとともに、マクロファージの活性化による一酸化窒素の発現上昇が引き起こされます。このように、MRP14による炎症性反応が肝細胞の壊死につながり、結果として肝障害が引き起こされることがわかりました。
本研究の成果により、MRP14の阻害によるマラリア肝障害の症状マネジメントといった、マラリアの新たな治療法につながることが期待されます。
発表内容
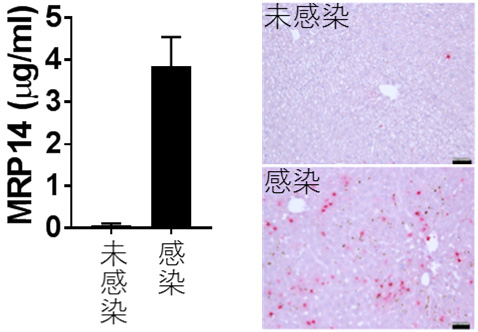
図1 マラリア原虫感染による血清中MRP14の上昇(左)および肝臓中MRP14陽性細胞の増加(右)。(拡大画像↗)
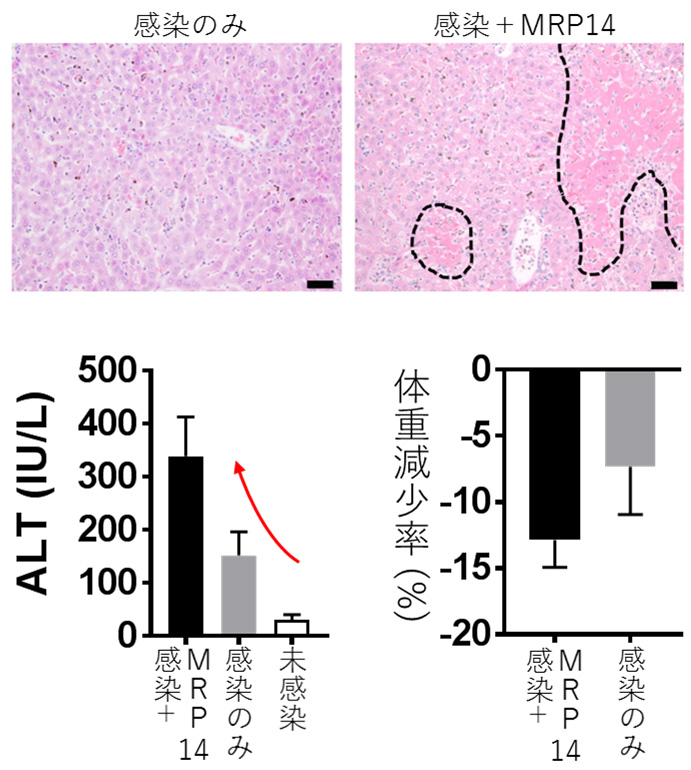
図2 MRP14の投与によるマラリア肝障害の悪化。(上段)マラリア原虫感染マウスに組換えMRP14を投与したところ、肝細胞の壊死が増強された(点線部)。(下段)MRP14を投与した感染マウスにおける血中肝酵素のさらなる上昇(左)および体重減少の悪化(右)。(拡大画像↗)
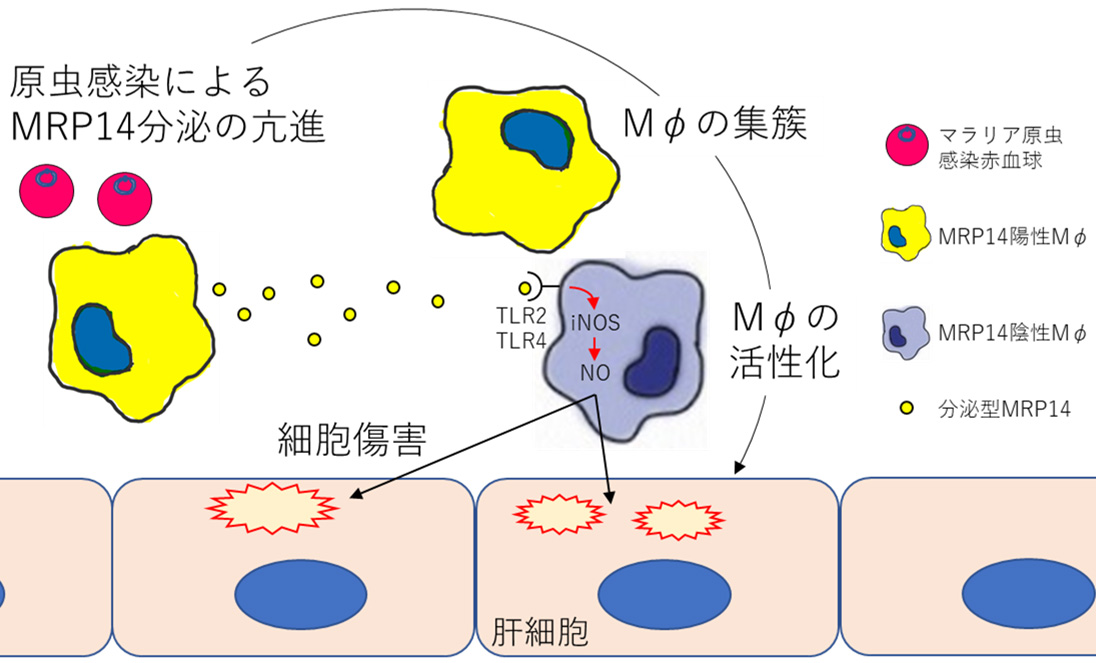
図3 MRP14を介したマラリアにおける肝障害の発症モデル(拡大画像↗)
病原体によって引き起こされる感染症において、私たちの免疫システムは生体防御に非常に重要な役割を担っています。一方で、花粉症や関節リウマチなど、免疫システムの「不適切な」反応が『免疫病態』を形成することもしばしばあります。感染症においても、病原体を排除する防御免疫と症状につながる病態免疫は表裏一体で切り離せるものではなく、両者の正しい理解を通して最適なバランスに導くことが重要であると考えられます。
マラリアにおける肝障害は、患者に黄疸がみられるなど古くから知られていたものの、その重要性については広く認められてはいませんでした。しかしながら、近年の疫学研究により、重症度の高い熱帯熱マラリア(注1)だけでなく、比較的軽症だと考えられてきた三日熱マラリア(注1)においても肝障害が見つかっていることから、その発症機構の解明が望まれています。そこで私たちは、その発症に宿主因子MRP14が関与するのでは、と考えて研究を行いました。
MRP14はS100ファミリー(注3)に属し、好中球の細胞質タンパク質としては最も豊富なものの一つであり、また単球にも高く発現するタンパク質です。炎症性マクロファージにも発現することが知られており、関節リウマチなどの炎症性疾患では患部にMRP14陽性細胞の集簇が見られるとともに、血中MRP14の上昇がみられることから、病態との関係が示唆されてきました。マラリア原虫感染マウスにおいても、血中MRP14濃度は未感染マウスと比較して高く、また肝臓におけるMRP14陽性細胞の集簇が強く誘導されます(図1)。これらのことから、分泌型MRP14がマラリア原虫感染時における肝障害の病態形成に関与していると考えられました。
そこで、MRP14の関与を直接的に示すために、感染マウスに組換えMRP14を静脈内投与して、マラリア肝障害が悪化するかどうか試験を行いました。その結果、MRP14を投与した群では、感染のみと比較してより重度な肝細胞の壊死が観察され、それに伴いさらなる血中肝酵素の上昇や体重減少が見られました(図2)。また、MRP14を投与した感染マウスでは、肝臓へのMRP14陽性マクロファージの集簇が増強されていました。このMRP14投与による肝臓への細胞集簇は未感染マウスでも見られることから、これらはマラリア感染に限らずMRP14が持つ細胞集簇能によるものだと考えられます。同時に、MRP14はToll様受容体(注4)のうちTLR2とTLR4のデュエルアゴニストであることや、炎症関連因子の一つである一酸化窒素の産生を増強することも明らかとなりました。
一方、MRP14を欠損したマウスでは、分泌型MRP14が存在しないにも関わらず、マラリア原虫感染時に野生型マウス同様に肝障害が見られました。この結果は、MRP14が分泌型による炎症促進能だけでなく、細胞内シグナルなど様々な機能を持つことに起因すると考えられます。実際、MRP14を欠損したマウスでは骨髄細胞の刺激応答性はむしろ増強されており(Mizobuchi H et al., Immunol Lett, 2018)、免疫応答という観点だけでもMRP14の多面性が示唆されました。
以上のことから、マラリアにおいては分泌型MRP14によるマクロファージの集簇と活性化がループ的に起こり、一酸化窒素の上昇を伴う炎症反応の増強が誘導され肝障害につながることが示唆されました(図3)。本研究は、感染症における生体防御に重要な役割を果たすマクロファージ自身が症状の原因となっていることや、その分子機構を明らかにするもので、「病気」というものの理解を深める一助となります。また、近年の研究によりMRP14に対する拮抗作用をもつ低分子化合物も開発され、ヒトでの治験も実施されています。今後これらの薬剤が開発されたあかつきには、マラリアの症状の一つである肝障害を緩和する治療法の開発につながることも期待できます。
本研究は日本学術振興会の科学研究費補助金による支援を受けて実施されました。
発表雑誌
- 雑誌名
- :PLOS ONE
- 論文タイトル
- :Exacerbation of hepatic injury during rodent malaria by myeloid-related protein 14
- 著者
- :Haruka Mizobuchi, Wataru Fujii, Shoko Isokawa, Kanna Ishizuka, Yihan Wang, Sayoko Watanabe, Chizu Sanjoba, Yoshitsugu Matsumoto, Yasuyuki Goto
- DOI番号
- :10.1371/journal.pone.0199111
- 論文URL
- :https://doi.org/10.1371/journal.pone.0199111
問い合わせ先
准教授 後藤 康之(ごとう やすゆき)
Tel:03-5841-7569
E-mail:aygoto<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 マラリア
- ハマダラカの吸血を介したマラリア原虫の感染によって引き起こされる寄生虫性疾患で、世界91カ国で年間2億人を超える患者と40万人以上の死者をもたらしている(2016年)。初期症状は発熱、頭痛、悪寒などがあり、重症化すると重度貧血、呼吸不全、脳マラリアなど命の危険をともなう。感染するマラリア原虫の種によって症状にも違いがあるため、熱帯熱マラリア、三日熱マラリアというように区別されている。
世界保健機関のウェブサイト http://www.who.int/malaria/en/
- 注2 マクロファージ(Mφ)
- 白血球の一つで、病原体など異物を貪食・消化する働きを持つ免疫細胞である。大食細胞ともよばれる。直接的な消化作用のみならず、炎症関連因子を分泌することにより、周辺の細胞の活性化を担うこともある。また、取り込んだ病原体由来のタンパク質を断片化してリンパ球に提示することで、病原体に特異的なリンパ球の活性化を誘導する能力も持つ。異物の侵入を許しやすい皮膚や肺、異物の処理を行う脾臓や肝臓には常在性のMφがいるのに対して、感染・炎症部位には骨髄・血液から炎症性Mφが動員される。
- 注3 S100ファミリー
- EF-handカルシウム結合ドメインを持つタンパク質群で、現在では20種類以上が知られている。細胞増殖や分化、イオンバランスの保持といった細胞内での役割に加えて、分泌型として炎症反応の誘起や抗菌作用など、機能が多岐にわたる。
- 注4 Toll様受容体(Toll-like receptor: TLR)
- 様々な病原体由来因子を認識する受容体で、自然免疫において重要な役割を果たす。細菌由来のリポ多糖を認識するTLR4やウイルス由来の一本鎖RNAを認識するTLR7など、受容体ごとに認識する病原体由来分子が異なる。これら受容体を介して細胞が活性化されると、炎症反応の増強や抗ウイルス作用をもつ分子の産生が促される。生体防御に資する一方、細菌由来リポ多糖によるショック症状に貢献するなど病態免疫においても重要な分子である。