東京大学大学院農学生命科学研究科 研究成果
2018/09/25
細菌が澱粉を独り占めするために使われている酵素の構造を解明
- 発表者
- 河野 正樹(株式会社 林原 研究部門 新素材開発部 研究員/東京大学 大学院農学生命科学研究科 応用生命工学専攻 社会人博士課程学生;当時)
荒川 孝俊(東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
太田 弘道(岡山大学自然生命科学研究支援センター 助教)
森 哲也(株式会社 林原 研究部門 新素材開発部 チームリーダー)
西本 友之(株式会社 林原 研究部門 新素材開発部 部長)
伏信 進矢(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
発表のポイント
◆
グルコースが環状に四個連なった糖質の分解に関わる細菌由来の酵素の立体構造を明らかにしました。
◆環状α-1,6マルトシルマルトース分解酵素の構造を決定し、そのユニークな分子機構を明らかにしました。
◆細菌が炭素源獲得競争を有利にするための代謝経路の詳細が判明しただけでなく、今後の新規オリゴ糖の創出や既存オリゴ糖製法の改善にも役立つことが期待されます。
◆環状α-1,6マルトシルマルトース分解酵素の構造を決定し、そのユニークな分子機構を明らかにしました。
◆細菌が炭素源獲得競争を有利にするための代謝経路の詳細が判明しただけでなく、今後の新規オリゴ糖の創出や既存オリゴ糖製法の改善にも役立つことが期待されます。
発表概要
環状オリゴ糖はいくつかの糖が環状に連なったオリゴ糖であり、安定性に優れ、還元性をもたないことからメイラード反応(注1)も起こしません。そのため、現在食品のみならず多くの分野で利用されています。環状α-1,6-マルトシルマルトース(CMM)は、株式会社 林原の研究部門が発見した四つのグルコースから構成される環状オリゴ糖の一種です。このCMMは一般的なアミラーゼ(α-アミラーゼ;注2)では分解されませんが、CMMヒドロラーゼ(CMMase)という特殊な酵素によって効率的に分解されることが明らかとなっていました。今回、東京大学大学院農学生命科学研究科の河野正樹 社会人博士課程(当時)、伏信進矢教授らのグループは、このCMMaseの立体構造を明らかにしました。その結果、CMMaseはCMMがぴったりとはまるようなポケットを持っており、その形は三つの特徴的な箇所によって支えられていることが明らかとなりました。さらに、このようにCMMに対応した特徴的なポケットを持つ類似の酵素遺伝子は、その他の多くの細菌にも存在していることがわかりました。本研究は、細菌が炭素源獲得競争を有利にするためのユニークな代謝経路に関する新たな知見を与えただけでなく、今後のオリゴ糖開発や製法改善にも役立つことが期待されます。
発表内容
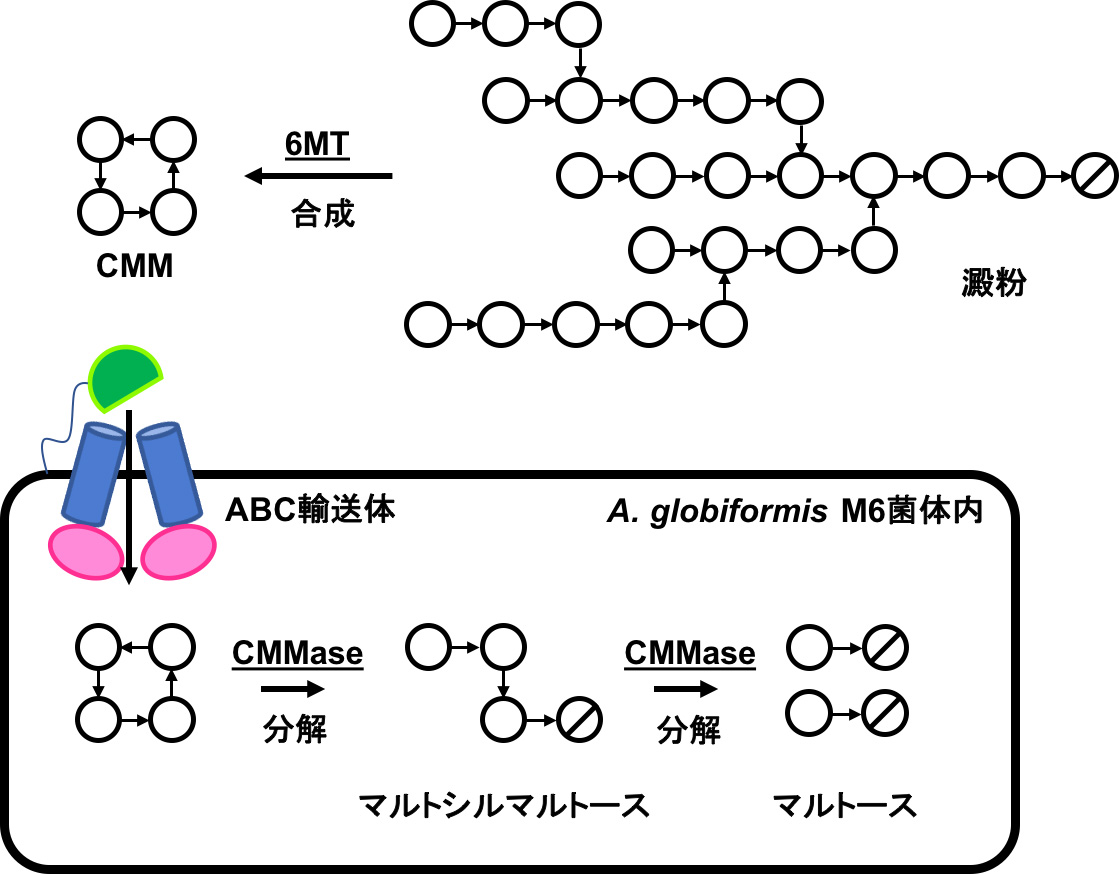
図1 A. globiformis M6株におけるCMMを経由した澱粉の代謝経路
白丸および斜線白丸はそれぞれグルコースおよび還元末端グルコースを表している。水平および垂直矢印はそれぞれα-1,4および1,6結合を表しており、矢印の根元がグルコースの一位のヒドロキシル基を示している。まず菌体外で6MTが澱粉に作用し、特殊な環状糖であるCMMを合成する。このCMMはABC輸送体によって菌体内に取り込まれ、CMMaseを用いて分解することで栄養源として利用できる。 (拡大画像↗)
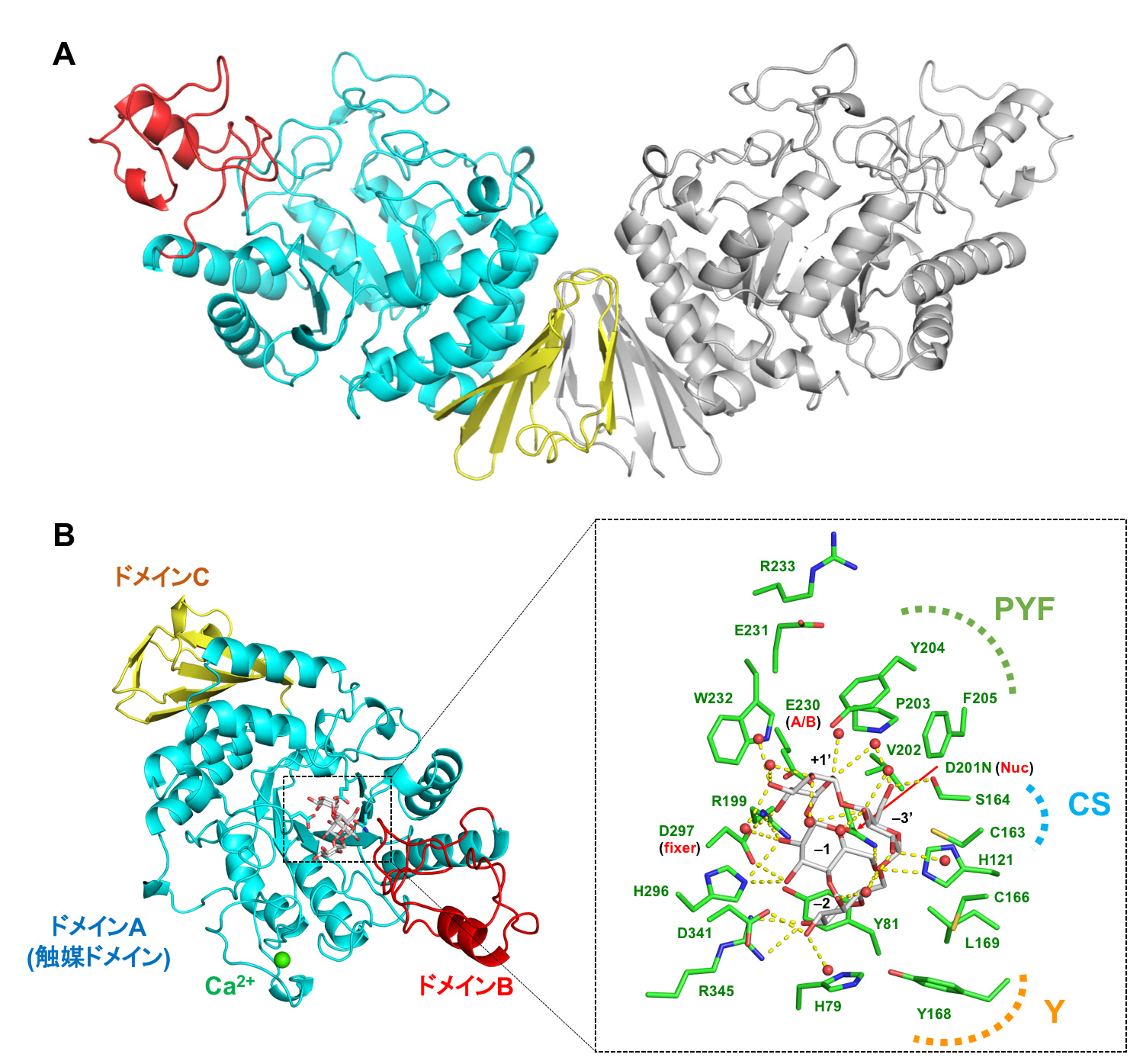
図2 CMMaseの全体構造(A)とCMMとの複合体構造(B)
A: CMMaseは溶液中においても、2つの分子が結合することによって非常にユニークな羽状の二量体構造を取っている。
B: 基質であるCMM(灰色)が基質結合ポケットにぴったりとはまっており、周辺のアミノ酸残基(緑色)や水分子(赤色の球)と多くの相互作用を形成していた。特に、PYF、CSおよびYと称する部分がCMMの特異性に重要であることが明らかとなった。 (拡大画像↗)
株式会社 林原の研究部門は、2005年に土壌中の微生物であるArthrobacter globiformis M6株が四つのグルコースから構成される新規の環状オリゴ糖(環状四糖)を作り出していることを発見しました。それまでに、環状四糖としてはα-1,3、1,6グリコシド結合(注4)が交互に存在する一種類(環状α-1,6-ニゲロシルニゲロース;CNN)しか知られておらず、ここで新たに見つかったものはα-1,4、1,6結合が交互に存在する環状α-1,6-マルトシルマルトース(CMM)でした。そして、このCMMは、α-1,4結合を加水分解する一般的なα-アミラーゼやその他の分解酵素でも分解されませんでした。さらに、このCMMを作り出す酵素(6-α-マルトシルトランスフェラーゼ;6MT)とCMMを分解する酵素(CMMヒドロラーゼ;CMMase)を発見して、これら酵素の遺伝子の隣には、菌体内へCMMを取り込む輸送体の遺伝子が存在していたことから、本菌が新たな環状糖であるCMMを経由して澱粉をエネルギー源として利用する代謝経路を持つことが見出されました(図1)。
株式会社 林原 研究部門 新素材開発部 河野正樹 研究員は同社に入社後、社会人博士課程の学生として東京大学大学院農学生命科学研究科の伏信進矢教授、荒川孝俊助教らのグループに加わり本研究を行いました。研究グループはCMMの酵素の立体構造と分子機構を明らかにしました。
CMMaseは糖質加水分解酵素(注5)ファミリー13のサブファミリー20(GH13_20)に属しており、同じファミリーには基質特異性が幅広いものや糖転移活性を示すような酵素が多く存在しています。しかし、CMMaseはCMMに非常に特異的であり、加水分解しか行わないことから、この酵素がどのようにCMMを認識し、加水分解を行っているのかに興味が持たれました。そこで、この酵素の立体構造をX線結晶構造解析(注6)により調べ、同じGH13_20に属しているネオプルラナーゼと比較を行いました。ネオプルラナーゼは基質特異性が幅広く、加水分解のみならず、糖転移活性も示すユニークな酵素として知られていますが、CMMを分解することができません。CMMaseの主鎖構造(単量体の構造)はネオプルラナーゼとよく似ていましたが、四次構造(二量体の構造)が大きく異なっており、ユニークな羽根状の四次構造を形成していました(図2A)。また、基質が結合するポケットはCMMがぴったりと当てはまるような形になっていることがわかりました。このポケットはPYF(プロリン、チロシン、フェニルアラニン)、CS(システイン、セリン)およびY(チロシン)からなり(図2B)、ネオプルラナーゼなど他のGH13_20に属する酵素とは全く異なっていました。そこで、CMMaseのこの三箇所のアミノ酸をネオプルラナーゼと同じものに変えたところ、CMMを分解する効率が著しく低下することを確認しました。したがって、CMMaseのCMMに対する特異性はこの三箇所のアミノ酸によってつくられた触媒ポケットの全体的な形状によって支えられていることがわかりました。また、岡山大学自然生命科学研究支援センターの太田弘道助教によってCMMの単結晶構造解析が行われ、CMMaseに結合したCMM分子と比較したところ、酵素に結合したCMMは最小エネルギー構造の一つをとっていることが明らかとなりました。さらに、本研究から得られた知見を元に類似酵素を探したところ、Arthrobacter globiformis以外にも多くの菌種においてCMMaseと同様の活性を持つと考えられる酵素が存在していることが明らかとなりました。そのため、これらの菌種においても、A. globiformis M6株と同様のCMM代謝経路を持っていることが考えられます。
今回、CMMaseの立体構造を解明することにより、特殊な環状オリゴ糖であるCMMをA. globiformis M6株が菌体内で分解して利用する分子機構の一端が明らかとなりました。今後はCMMの生成および取り込みに関わる酵素・タンパク質についてのさらなる研究が必要ですが、このような特殊な代謝経路を持つ生物学的意義としては澱粉を一度環状オリゴ糖に変換することによって他の細菌が食べることのできないようにし、独占してしまうことであると考えられます。そして、本研究は環状オリゴ糖代謝経路の研究において重要な知見を提供しただけではなく、今後の新規オリゴ糖の創出や既存オリゴ糖製法の改善にも役立つことが期待されます。
発表雑誌
- 雑誌名
- : 「The Journal of Biological Chemistry」(掲載日:2018年9月4日)
- 論文タイトル
- :Structural features of a bacterial cyclic α-maltosyl-(1→6)-maltose (CMM) hydrolase critical for CMM recognition and hydrolysis.
- 著者
- :Masaki Kohno, Takatoshi Arakawa, Hiromi Ota, Tetsuya Mori, Tomoyuki Nishimoto, Shinya Fushinobu*
- DOI番号
- :10.1074/jbc.RA118.004472
- 論文URL
- :http://www.jbc.org/content/early/2018/09/04/jbc.RA118.004472
問い合わせ先
教授 伏信 進矢(ふしのぶ しんや)
Tel:03-5841-5151
Fax:03-5841-5151
研究室URL:http://enzyme13.bt.a.u-tokyo.ac.jp/
用語解説
- 注1 メイラード反応(アミノカルボニル反応)
- カルボニル化合物(還元性糖、ポリフェノールなど)がアミノ基を有する化合物(アミノ酸、ペプチド、タンパク質など)との共存下において加熱され、主に褐色物質であるメイラジンを生成する反応のこと。
- 注2 アミラーゼ
- アミラーゼは、ヒトを含めて動植物から微生物まで幅広く存在している加水分解酵素である。基本的には澱粉とその構成成分であるアミロースやアミロペクチンなどに作用し、様々な長さのオリゴ糖や長さの短くなったアミロースやアミロペクチンを生成する。
- 注3 トレハロースとサイクロデキストリン
- トレハロースはグルコースがα, α-1,1結合した非還元性の二糖であり、動植物など幅広く自然界に存在し、特にきのこ類などに多く含まれている。澱粉の老化抑制、タンパク質の変性抑制、保湿作用などの物性機能や耐糖能改善効果、オートファジー促進効果などの生理機能を示す。サイクロデキストリンは、6~8個のグルコースがα-1,4結合によって環状に連なったオリゴ糖であり、内側が疎水性の樽のような構造となっていることから脂質や薬剤などの有用な疎水性物質の可溶化効果を示す。このような性質から、両オリゴ糖は物性機能を示す機能性オリゴ糖の代表として幅広く利用されている。
- 注4 グリコシド結合
- 単糖のヒドロキシル基が他の糖もしくはアルコールなどのヒドロキシル基との脱水縮合反応により形成される結合のこと。グリコシド結合は、糖の平面構造より垂直な向きに結合したα-グリコシド結合と水平な向きに結合したβ-グリコシド結合が存在する。グルコースでは五つのヒドロキシル基を有しており、五つのグリコシド結合(α-もしくはβ-1,1、1,2、1,3、1,4、1,6)を形成可能である。
- 注5 糖質加水分解酵素
- アミラーゼ、セルラーゼなど、糖質のグリコシド結合に作用して加水分解する酵素の総称でGlycoside Hydrolaseと呼ばれる。フランスのHenrissatらによりファミリー分類がなされており(http://www.cazy.org/)、Glycoside Hydrolaseのファミリーは現在1番から153番まで知られている。また、各ファミリーはそのアミノ酸配列と活性中心の種類や位置などに基づいてサブファミリーに分類することができる。CAZyにおいて、GH5、13、30、43は公式にサブファミリーが割り振られている。
- 注6 X線結晶構造解析
- 酵素などのタンパク質の立体構造を明らかにするための最も一般的な解析方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることができる。本研究では、茨城県つくば市の高エネルギー加速器研究機構(KEK)物質構造科学研究所(IMSS)の放射光科学研究施設フォトンファクトリー(PF)と兵庫県佐用郡佐用町の大型放射光施設SPring-8を用いてX線測定実験を行った。