妊娠期の母親の栄養によって子供が将来高血圧になりやすい仕組みに関与するDNA修飾変化の発見
- 発表者
- 三好 萌 (東京大学大学院農学生命科学研究科応用生命化学専攻 博士課程2年)
佐藤 正幸 (東京大学大学院農学生命科学研究科応用生命化学専攻 大学院生:当時)
齋藤 憲司 (東京大学大学院農学生命科学研究科応用生命化学専攻 農学共同研究員)
大谷 りら (東京大学大学院農学生命科学研究科応用生命化学専攻 特任研究員:当時)
白髭 克彦 (東京大学大学院医学系研究科医科学専攻 教授)
三浦 史仁 (九州大学大学院医学研究院基礎医学部門 講師)
伊藤 隆司 (九州大学大学院医学研究院基礎医学部門 教授)
賈 慧娟 (東京大学大学院農学生命科学研究科応用生命化学専攻 特任准教授)
加藤 久典 (東京大学大学院農学生命科学研究科応用生命化学専攻 特任教授)
発表のポイント
◆胎児期低タンパク質食暴露により食塩感受性高血圧が亢進する現象について、DNAメチル化状態を初めて網羅的に調べて関与する変化を報告しました。
◆食塩感受性高血圧の発症機構にエピジェネティック変化が関与している可能性が示唆され、高血圧の新たな予防・治療ターゲットとなることが期待されます。
発表概要
妊娠中に低タンパク質食を摂取させた母獣から生まれた高血圧モデル仔ラット(SHRSP)(注1)は、成長後に1%食塩水を飲料水として2週間与えると、血圧が顕著に上昇し、食塩感受性高血圧(注2)を発症するリスクが高まることが知られています。しかし、この食塩感受性高血圧に至るメカニズムに関しては不明な点が多く残されていました。
東京大学大学院農学生命科学研究科の加藤久典特任教授らの研究グループは、成獣SHRSP仔ラットの腎臓内のエピジェネティック変化(注3)を探索し、妊娠期に低タンパク質食を与えた母獣から生まれた仔ラットは、血圧調節に関連するプロスタグランジンE2(注4)受容体遺伝子(ptger1)近傍のDNAメチル化(注5)状態と遺伝子発現量が変化していることを明らかにしました。今回の研究により、胎児期低タンパク質暴露に起因した食塩感受性高血圧亢進に関連するエピジェネティック変化の一端が初めて示唆されました。本研究は、食塩感受性高血圧の胎児期起源の分子機構を解明することを試みたものであり、高血圧の新たな予防や治療戦略の知見として役立つことが期待されます。
発表内容
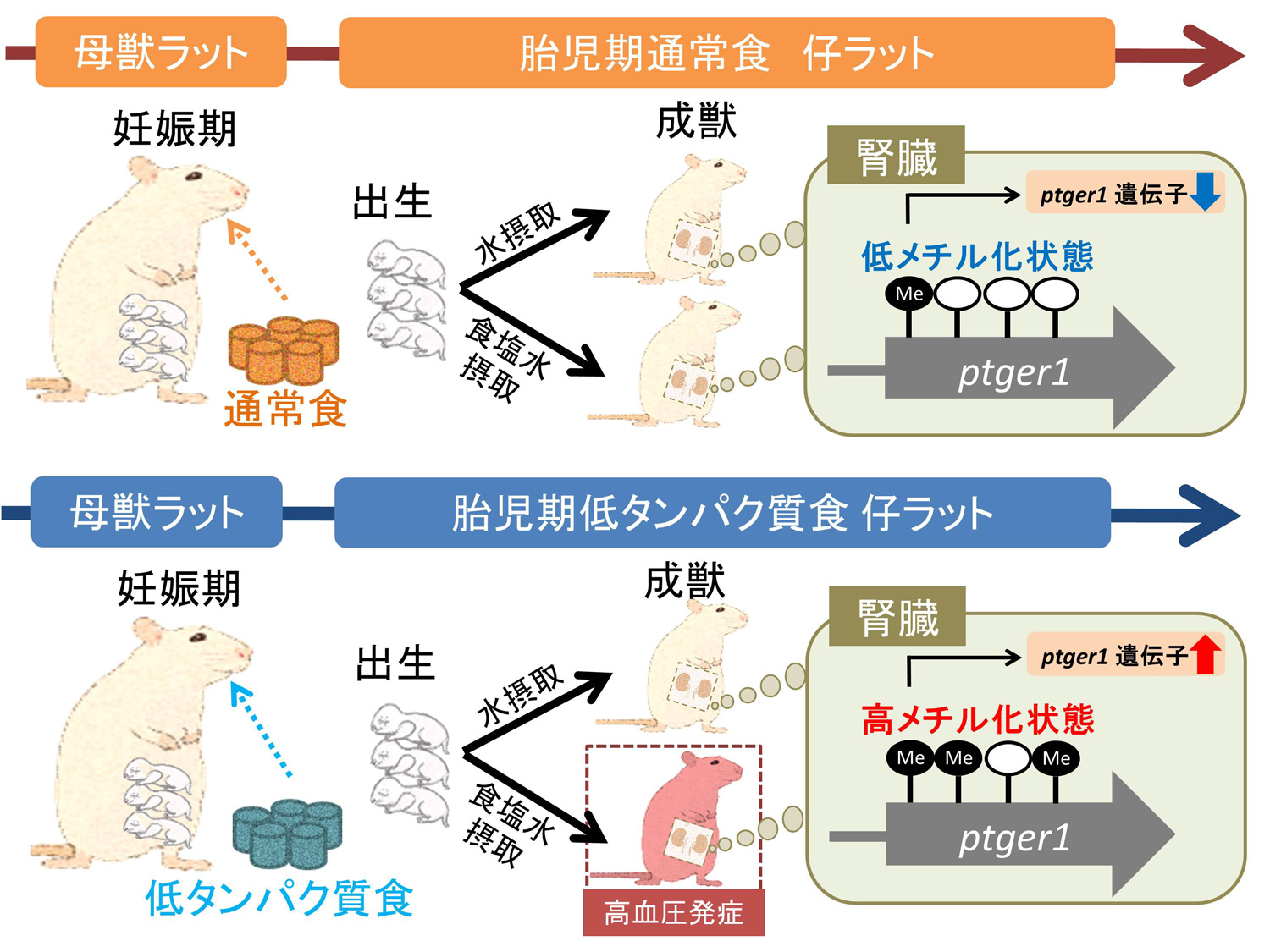
図 本研究により得られた知見
胎児期に低タンパク質食暴露された仔ラットは、成長後の食塩飲水の有無に関わらず、血圧調節に関わる遺伝子(ptger1)領域のDNAのメチル化状態が高値であり、ptger1遺伝子レベルは増加していた。(拡大画像↗)
高血圧モデルラットであるSHRSP(注1)を用いた研究において、胎児期に低タンパク質栄養に暴露されると仔ラットは成長後に食塩感受性高血圧(注2)が亢進すること、さらにその影響は孫世代にまで及ぶことが明らかとなっています。その分子機構として、腎臓内において血圧調節に関わるレニン・アンジオテンシン・アルドステロン系の酵素やレセプターのタンパク質発現量の変化が既に報告されています。しかし、どのようなエピジェネティック変化が関与しているかは分かっておらず、未解明な点が多く残されています。東京大学大学院農学生命科学研究科の加藤久典特任教授らの研究グループは、ゲノム全体のメチル化解析(メチローム解析)を行い、腎臓内において血圧調節に関連するプロスタグランジンE2(注4)受容体遺伝子(ptger1)近傍のDNAメチル化(注5)状態が母獣の栄養状態の影響を受けやすいことを見出し、この遺伝子に着目しました。
妊娠期のSHRSPに低タンパク質食(9%カゼイン食)または通常食(20%カゼイン食)を与え、出生後の仔ラットには通常食と水道水を与えました(水飲水グループ)。一部のラットには、10週齢から2週間、飲料水を1%食塩水に切り替えました(食塩飲水グループ)。これらの仔ラットは全て成獣期(12週齢)に解剖を行い、腎臓を回収しました。
腎臓内のptger1近傍のDNAメチル化状態を、バイサルファイトシーケンス法(注6)により評価しました。その結果、胎児期に低タンパク質食暴露された仔ラットは、成長後の食塩飲水の有無に関わらず、DNAのメチル化状態が高値を示すことが明らかとなり、胎児期栄養によりptger1近傍のDNAのメチル化状態が変化することが示唆されました。また、腎臓内のptger1遺伝子発現量を測定したところ、胎児期に低タンパク質食暴露された仔ラットは、成長後の食塩飲水の有無に関わらず、ptger1遺伝子発現量が顕著に増加していました。したがって、ptger1近傍のDNAの高メチル化状態は、ptger1遺伝子発現量を正に制御している可能性があることが考えられました(図)。
ptger1の下流遺伝子であり、腎臓内において上皮性ナトリウムチャネル(注7)をコードしている遺伝子(enacα)は、ptger1により負に制御されることや、アルドステロン(注8)存在下では正に制御されることが報告されています。本研究でenacα遺伝子発現量を測定したところ、胎児期に低タンパク質食暴露された水飲水グループの仔ラットは、胎児期に通常食を摂取させた母獣由来の仔ラットと比較して、enacα遺伝子発現量に差は見られませんでした。一方、食塩飲水グループでは、胎児期に低タンパク質食暴露された仔ラットのenacα遺伝子発現量が有意に減少していました。続いて、血中アルドステロン濃度を測定した結果、胎児期に低タンパク質食暴露された水飲水グループの仔ラットのみ、血中アルドステロン濃度が顕著に上昇していることが明らかとなりました。胎児期に低タンパク質食暴露された食塩飲水グループの仔ラットは、ptger1の影響によりenacα遺伝子発現量が低下し食塩感受性高血圧に至った可能性が示唆されました。
本研究は、胎児期低タンパク質暴露に起因した食塩感受性高血圧亢進に関連するエピジェネティック変化の一端を初めて示唆しました。食塩摂取が高血圧に及ぼす影響には個人差があることが知られており、個人の体質に合わせた食塩摂取量の指導、予防法や治療法の確立が必要とされています。胎児期低栄養環境は、食塩感受性高血圧発症の個人差に繋がる一要因であるため、本研究の成果は高血圧の新たな予防や治療戦略の知見として役立つことが期待されます。
発表雑誌
- 雑誌名
- :Nutrients
- 論文タイトル
- :Maternal Protein Restriction Alters the Renal Ptger1 DNA Methylation State in SHRSP Offspring
- 著者
- :Moe Miyoshi, Masayuki Sato, Kenji Saito, Lila Otani, Katsuhiko Shirahige, Fumihito Miura, Takashi Ito, Huijuan Jia and Hisanori Kato*
- DOI番号
- :10.3390/nu10101436
- 論文URL
- :https://doi.org/10.3390/nu10101436
問い合わせ先
特任教授 加藤 久典(かとう ひさのり)
Tel:03-5841-1607
Fax:03-5841-1607
E-mail:akatoq<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
研究室URL:http://park.itc.u-tokyo.ac.jp/food/
用語解説
- 注1 SHRSP
- 高血圧と脳卒中を自然発症する遺伝素因を有した高血圧モデルラット。
- 注2 食塩感受性高血圧
-
食塩摂取が要因となり発症する高血圧。
- 注3 エピジェネティック変化
- DNA塩基配列の変化を伴わない変化。代表的なエピジェネティック変化として、DNAメチル化やヒストン修飾の変化が知られています。胎児期環境が子の細胞に記憶される仕組みとしてエピジェネティック変化の関与が指摘されています。
- 注4 プロスタグランジンE2
- 生理活性物質であるプロスタグランジンの一種であり、腎臓内において腎血流量や糸球体での濾過量を調節したり、抗利尿ホルモンの作用を調節したりする働きがあります。プロスタグランジンE2受容体は、細胞膜7回貫通型のGタンパク質共役受容体です。
- 注5 DNAメチル化
- DNA中の主にシトシン(C)の炭素原子にメチル基が付加する化学反応。シトシンの次にグアニン(G)が現れるCpG配列部分はDNAメチル化が起こり易いことが指摘されています。
- 注6 バイサルファイトシーケンス法
- DNAメチル化解析手法の一種。まず、バイサルファイト処理により、DNA 中のメチル化されていないシトシン(非メチル化シトシン)をウラシルに変換し、メチル化シトシンと非メチル化シトシンを区別します。次に、バイサルファイト処理後のDNAを増幅させ、シーケンス解析によりその塩基配列の差を検出することによって、最終的にDNAメチル化の有無を判定します。
- 注7 上皮性ナトリウムチャネル
- 腎臓において、糸球体で濾過されたナトリウムの最終的な排泄量を調節する重要なチャネル。上皮性ナトリウムチャネルをコードしている遺伝子には3つのサブタイプ(α, β, γ)があり、αは主要なサブタイプです。
- 注8 アルドステロン
- 副腎皮質で合成・分泌されるホルモン。腎臓におけるナトリウム再吸収は、アルドステロンの分泌により促進されることが知られています。