| 2006/7/21 |
|
発表者:伊東 孝祐 (食品工学研究室 産学官連携研究員)
田之倉 優 (食品工学研究室 教授)
発表雑誌
米国生化学会誌 (Journal of Biological Chemistry) 7/21/2006号に掲載。
(Journal of Biological Chemistry, Vol. 281, Issue 29, 20567-20576, July 21, 2006)
概要
有害性合成色素を分解する微生物の酵素、AzoRの立体構造を原子レベルで解明することに成功した。この成果は、環境汚染物質を浄化する技術開発に大きく貢献すると期待される。
発表内容・その他
世界的規模での産業の発展にともない、環境汚染物質を浄化する技術開発が急務となっている。そのなかで、微生物の酵素を利用した浄化システムは、化学的浄化システムと比較して、低コスト、かつマイルドな条件下で安全に環境汚染物質を分解できることから現在最も注目を浴びている。タンパク質工学の分野にいたっては、これらの酵素を改変し、環境汚染物質の分解機能を向上させる研究が盛んに行われているが、このことを実現するためには酵素の立体構造を原子レベルで知ることが必要不可欠である。なぜなら、酵素の基質認識や反応機構はその立体構造にもとづいているからである。我々の研究室では、こういった微生物の酵素の立体構造を原子レベルで解明することに積極的に取り組んでおり、このほど合成色素の一種であるアゾ化合物を高効率に分解する大腸菌由来の酵素、AzoRの立体構造を原子レベルで解明することに成功した。この成果により、アゾ化合物分解酵素の研究開発が飛躍的に発展すると期待される。
アゾ化合物とはアゾ基(-N=N-)を持つ合成色素の総称である。アゾ化合物は製造が容易で安定なことから、印刷、染色、着色料、化粧品など様々な用途で大量に使用されている。だがその安定性のため、一度環境中に放出されると自然界の浄化作用では分解されずに環境汚染を引き起こす。なかには、遺伝子変異を引き起こすなどの有害性があるものも数多く存在することが知られている。一方、AzoRはアゾ化合物を分解する微生物のスクリーニングの過程で、有害性でかつ汎用性の高いアゾ化合物、メチルレッドを分解する酵素として同定された大腸菌由来の酵素である。現在までの酵素学的研究により、AzoRはNADH(ニコチンアミドアデニンジヌクレオチド)を電子供与体、FMN(フラビンモノヌクレオチド)を補酵素として、アゾ基を還元分解する酸化還元酵素であることがわかっている。しかしながら、これまでにAzoRのような高いアゾ分解活性をもつ酵素の立体構造に関する報告はなく、その反応の分子機構は不明であった。
我々は、X線構造解析*)によってAzoRとFMNとの複合体の立体構造を原子レベルで解明することに成功した。立体構造は2種類の異なった結晶から得られ、分解能はそれぞれ1.8 A*)、2.2 Aであった。本研究により得られた知見を以下に記述する。
1. AzoRの全体構造
AzoRの全体的な構造は、中心部に5本のβ-シートがあり、その周囲を3本、および2本のα-へリックスがサンドイッチした形になっていた(図1)。また、活性中心*)が2つのモノマーからのアミノ酸残基によって形成されることから、AzoRはホモダイマーで機能発現する酵素でことが判明した(図2)。驚くべきことに、AzoRは微生物の酵素であるにもかかわらず、またアミノ酸配列に相同性が認められないのにもかかわらず、その立体構造は哺乳類の解毒酵素、DT-diaphoraseに似ているという学術的にも大変興味ある結果が得られた。DT-diaphoraseは、腫瘍治療のためのプロドラッグターゲットタンパク質として現在注目を集めている酵素でもある。
2. 活性中心部位
活性中心部位において、FMNは15本の水素結合によってポリペプチド部位と結合していた。通常、FMNのリン酸部位は静電的相互作用によってポリペプチド部位と結合するが、AzoRにおいてはその様な結合様式は認められず、水素結合による結合のみであった。また、FMNの一方向面はポリペプチド部位を向いていて空間が満たされており、もう片面でのみしか基質が接触できない形になっていた。このことは、活性部位に同時に2つの基質が結合しないping-pong mechanismで反応が進行するという酵素学的実験から得られた結果を可視的に証明するものであった。
2種類の結晶から得られ立体構造を比較したところ、活性中心周辺の構造は異なっていることが判明した。一方で、AzoRはメチルレッド以外のアゾ化合物も分解することが知られていた。つまりこのことは、酵素は活性中心付近の構造変化させることにより、形の違う化合物を取り込むということを分子レベルで証明するものであった。
3. 反応機構(2電子転移反応)の推測
通常NADHからFMNに2電子が供与される際には、FMNのイソアロキサジン環N5位をハイドライドイオンが攻撃し、N1位に水素イオンが結合するが、本酵素中のイソアロキサジン環N5近辺には水素イオンを供与するようなアミノ酸残基、および水分子が存在しない。しかしながら、イソアロキサジン環O2位は144His NE位と水素結合を形成しており、このNE位上の水素イオンがイソアロキサジン環O2位に結合することが考えられる。つまり、AzoRの立体構造から、AzoRの2電子転移の反応機構は互変異性をともなったものであることが示唆された(図3)。
現在までに、FMNのイソアロキサジン環とアミノ酸残基との水素結合の様式の違いにより、ハイドライドイオン転移の効率が違うことが報告されている。これらの水素結合様式の情報とAzoRの立体構造をもとに、タンパク質工学的手法によって、よりハイドライドイオン転移の効率がよいアゾ化合物分解酵素の開発が可能であろう。また、現在では立体構造から酵素と基質がどの様に結合するのかをシュミレーションすることができる。このことから、AzoRの基質特異性をタンパク質工学的手法により改変させることも可能であろう。以上の様に、AzoRの立体構造を原子レベルで決定したことにより、アゾ化合物分解酵素の研究開発が発展することは確かなことである。
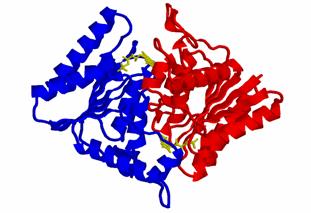
図 1 AzoR の全体構造
AzoR の全体構造をリボンモデルで表示した。ホモダイマーの一方を青色、もう一方を赤色として表示した。補酵素である FMN は黄色のスティックモデルで表示した。
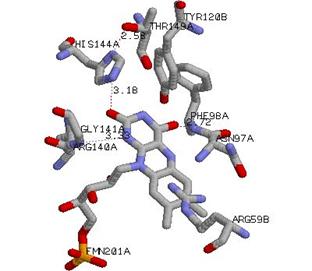
図 2 活性中心部位
活性部位周辺( FMN 周辺)のアミノ酸残基を示した。各々モノマーからのアミノ酸残基をそれぞれ A 、 B として表示した。両モノマー分子が活性発現に必要なことが考えられる。また、水素結合をドットラインで表示し、距離を A 単位で表示した。
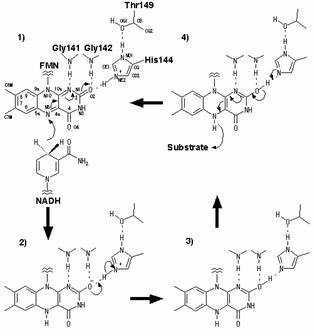
図 3 2 電子転移反応の推定
用語解説
・A:オングストローム(長さの単位)、1 A = 10-10 m
・活性中心:酵素タンパク質分子中において、基質が特異的に結合し、触媒作用を受ける部分をいう。
〒113−8657 東京都文京区弥生1−1−1 www-admin@www.a.u-tokyo.ac.jp
Copyright © 1996- Graduate School of Agricultural and Life Sciences, The University of Tokyo