| 2007/2/7 |
|
発表者:加藤 有介(応用生命化学専攻 特任助手)
田之倉 優 (応用生命化学専攻 教授)
発表概要
FBP11のWWドメインとMeCP2のPLモチーフとの相互作用の欠失はレット症候群発症につながるが、この相互作用機構を明らかにするためにFBP11 WW1-PLモチーフ複合体の溶液中での構造解析をNMRで行い原子座標を決定した。
発表内容
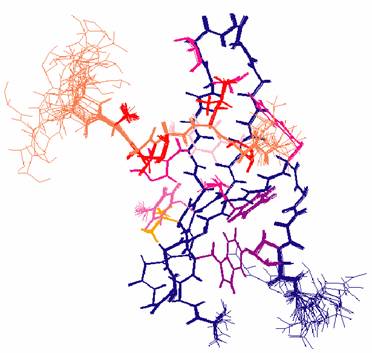
酵母の必須スプライシングファクターPrp40の哺乳類オーソログであるFBP11はハンチントン病やレット症候群などの神経性疾患発症機構に大きく関わる。またFBP11のWWドメインは植物開花制御タンパクFCAのWWドメインとも酷似している。これらのWWドメインはプロリンリッチ配列に結合することでこれらの機構を支配している。過去の我々の研究でこれらのWWドメインはグループII/III WWドメインというカテゴリーに分類された (Kato Y. et al. and Tanokura M. (2004) J. Biol. Chem. 279, 31833-31841)。グループII/III WWドメインのリガンドとの複合体構造はこれまで明らかにされていなかったから、これらのWWドメインがどのような機構でリガンド認識しているかはわかっていなかった。我々が決定した構造によればFBP11 WWドメインは主に分子表面にある芳香環側鎖によって連続するプロリン配列を認識していることが判った。これらの芳香環側鎖は2つの大きなくぼみ構造を形成しており、それらのくぼみにプロリンの環状構造が納まる様子が見られた。この相互作用様式はSH3ドメインに見られるようなプロリンリッチ認識機構とは異なっており、そのことによってWWドメインはSH3ドメインよりもさらに短い配列を認識できる。プロリンは生体内に存在する20種類のアミノ酸の中でアミドを持たない唯一のアミノ酸であることから、特異的ではあるが非常に弱いタンパク質間相互作用を可能にしている。実際FBP11 WWドメインとPLモチーフとの複合体の相互作用の強さはこれまでに報告されているどのタンパク質複合体よりも相互作用が弱いものの一つであり、サブミリモーラーレベルの解離定数を持つ。我々はこのような非常に不安定な複合体の立体構造解析を特異ラベルしたタンパク質と強力なNMRフィルター技術、それから最新の自動構造計算ソフトを用いて高精度(r.m.s値 0.1A以下)に決定することに成功した。また点変異導入タンパク質によるリガンド相互作用解析も行うことで立体構造解析の結果をサポートするデータも得られた。このような高精度の複合体立体構造は上記疾病に対する創薬研究の基礎として、あるいは生命現象の理解に役立つと考えられる。
発表雑誌
The Journal of Biological Chemistry Vol. 281, Issue 52, 40321-40329, December 29, 2006
“Structure of FBP11 WW1-PL Ligand Complex Reveals the Mechanism of Proline-rich Ligand Recognition by Group II/III WW Domains”
Kato Y., Miyakawa T., Kurita J. and Tanokura M.
用語解説
WWドメイン:アミノ酸残基数20-30のタンパク質ドメイン構造で、ジスルフィド結合やコファクターに依存しないドメイン構造としては最小のものである。そのリガンド特異性は広く、3つのグループに分類されているが、どれもプロリン含有配列と相互作用する点は共通である。そのうちグループII/IIIは特にプロリンに富む配列を好んで結合する。
NMR: 核磁気共鳴。原子核の出すシグナルとそのネットワークを検出しタンパク質立体構造解析を原子レベルで可能にする技術。
MeCP2: メチルCpG結合タンパク質。DNAのメチル化には必須のタンパク質で発生過程などでの遺伝子のサイレンシングを制御している。最近の知見ではMeCP2の遺伝子サイレンシング異常がシナプス信号伝達の異常を引き起こすことがわかった。
ハンチントン病:ハンチンチンというタンパク質の異常によって引き起こされるタンパク質凝集病。神経細胞を破壊するので患者は異常な運動行動や精神知能障害を起こす。このタンパク質凝集に多種のグループII/III WWドメイン含有タンパク質が巻き込まれていることがわかっている。
レット症候群:MeCP2とFBP11を含むグループII/III WWドメインとの間の相互作用が欠失することで生じる神経疾患。患者は異常な運動行動や知能障害を起こす。
SH3ドメイン:主にホルモン応答などで細胞外のシグナルを細胞内に伝達する際に重要な役割を果たすタンパク質ドメイン構造の一つ。プロリンリッチな配列を認識することから細胞内でグループ II/III WWドメインと一部共通のリガンドと相互作用すると考えられている。
複合体解析技術について:NMRによるタンパク質複合体立体構造解析にはフィルター技術が必須である。本研究では13Cと15Nで標識したWWドメインと何も特別な標識をしないリガンドとの間での相互作用NMRシグナルを検出するためにこの技術を用いた。不安定な複合体から生じる微弱な相互作用シグナルを検出するためには強力なフィルター技術が必要だった。
添付資料
URL http://www.jbc.org/cgi/content/full/281/52/40321
〒113−8657 東京都文京区弥生1−1−1 www-admin@www.a.u-tokyo.ac.jp
Copyright © 1996- Graduate School of Agricultural and Life Sciences, The University of Tokyo