| 2007/12/28 |
|
発表者: 高橋伸一郎 (応用動物科学専攻・准教授)
伯野史彦 (応用動物科学専攻・助教)
発表概要
私たちは、インスリンの細胞内シグナル伝達に重要な役割を果たしているインスリン受容体基質(IRS)と相互作用するタンパク質の同定を進めてきましたが、そのうちのひとつが53BP2Sというタンパク質でした。このタンパク質を発現させた脂肪細胞では、インスリンの代表的な生理作用である糖取り込みが阻害されていることを発見しました。
発表内容
インスリンは脂肪や筋肉などの標的組織・細胞に作用し、グルコーストランスポーターの細胞膜移行を誘導し、血中の糖を細胞内に取り込むことが知られており、この作用によって血糖値の恒常性が保たれています。糖尿病はこの恒常性が保たれず、血糖値が上昇する疾病ですが、特に2型糖尿病では、インスリンが血中に存在するにも関わらず、糖取り込みが起こらなくなってしまう、いわゆる「インスリン抵抗性」が発症の主な原因と考えられています。インスリン抵抗性は、細胞内でインスリンが生理活性を発現するまでのシグナル伝達に何らかの支障が起き、その結果、正常なインスリン作用が発現しなくなると想定されていますが、その詳細な分子機構は十分に明らかにされているとはいません。
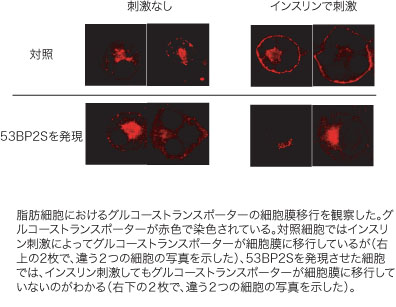
これまで私たちは、インスリンの細胞内シグナル伝達に重要な役割を果たしているインスリン受容体基質(IRS)と相互作用するタンパク質の同定を進めてきましたが、その過程で、IRSは多くのタンパク質と相互作用しており、巨大なシグナル分子複合体を形成していることを発見しました。そのタンパク質群のひとつが、細胞のアポトーシスを制御するタンパク質として同定された53BP2Sでした。このタンパク質を3T3-L1脂肪細胞に過剰発現しますと、インスリンによって誘導されるグルコーストランスポーターの細胞膜移行が阻害され、これは糖取り込みが抑制されていることを示しています。
このように、IRSを介して形成される巨大なシグナル複合体が、インスリンのシグナル伝達を制御し、生理活性を調節することが明らかになったことによって、インスリン抵抗性の発生機構に新しい観点を提供することができたと考えています。
発表雑誌
Journal of Biological Chemistry
Hakuno F, Kurihara S, Watson RT, Pessin JE, Takahashi S-I
53BP2S, interacting with insulin receptor substrates, modulates insulin signaling. J. Biol. Chem. 2007 282(52): 37747-58
問い合わせ先
用語解説
上記ホームページを参照
添付資料
〒113−8657 東京都文京区弥生1−1−1 www-admin@www.a.u-tokyo.ac.jp
Copyright © 1996- Graduate School of Agricultural and Life Sciences, The University of Tokyo