| 2007/4/23 |
|
発表者:西増弘志・伏信進矢・祥雲弘文・若木高善 (農学生命科学研究科応用生命工学専攻酵素学研究室)
発表概要
80℃の高温、pH2-3の酸性で生育する好酸好熱性古細菌Sulfolobusの原始的な糖代謝経路で働くヘキソキナーゼ(グルコースなどのリン酸化を行う酵素)の立体構造を、様々な基質との複合体状態で決定し、基質結合に伴う大きな構造変化、基質特異性の分子機構、リン酸転移反応におけるMg2+の役割など、従来のヘキソキナーゼでは分からなかった新たな特長を明らかにした。
発表内容
背景
多くの生物はエムデン・マイヤホフ経路によりグルコースをピルビン酸へと分解するのに対して、古細菌は特異な糖代謝経路によりグルコースを代謝する。なかでも好酸好熱性古細菌Sulfolobusは、グルコースのリン酸化を伴わない非リン酸化型エントナー・ドウドロフ経路によりグルコースを解糖することが知られている。
以前に我々は、Sulfolobusの細胞抽出液中にグルコースをリン酸化する活性を検出し、この活性を担う酵素(StHK)を精製し、遺伝子を同定した。さらに、生化学的解析により、StHKはグルコースだけでなくマンノース、グルコサミン、N-アセチルグルコサミンなどをリン酸化できる新規なヘキソキナーゼであることを明らかにした。しかし、通常のヘキソキナーゼと異なり、StHKが様々な糖をリン酸化できる分子機構は不明だった。
StHKは解糖系ではなく生合成に関与すると思われる。糖基質に対する特異性が低いことは、本酵素に限らず、Sulfolobus属の糖代謝系の酵素でよく見られる現象で、少数の酵素で幅広い代謝を行うのに適している。
方法と結果
StHKを異なる4つの状態[(1)StHK単独、(2)グルコースとの二者複合体、(3)ADPとの二者複合体、(4)キシロース、ADP、Mg2+との四者複合体]で結晶化し、X線結晶構造を1.65〜2.0 Å分解能で決定した。その結果、StHKはヘキソキナーゼファミリーに特徴的な2つのドメインからなる全体構造をしているが、基質認識に関わる独特のループ構造を持つことが明らかとなった。他のヘキソキナーゼとの構造比較により、StHKがグルコースとN-アセチルグルコサミンの両方を基質として利用できる分子機構が明らかとなった。StHK単独およびADP複合体では2つのドメインが開いているのに対し、グルコース複合体およびキシロース・Mg2+・ADP複合体では2つのドメインは閉じていることから、糖の結合が大きな構造変化を誘導することが示唆された。さらに、キシロース・Mg2+・ADP複合体は、ヘキソキナーゼファミリーで初めて酵素に結合したMg2+を可視化することに成功した例であり、リン酸転移反応におけるMg2+の役割の詳細な理解が可能となった。
ヘキソキナーゼは、30年前にグルコース結合に伴う酵素の構造変化がX線結晶構造解析により明らかにされており、誘導適合の代表例として教科書に掲載されている古典的な酵素である。しかし、同一の酵素において、酵素単独、糖との複合体、ヌクレオチドとの複合体、糖・Mg2+・ヌクレオチドとの複合体という4つの状態における構造が決定されている例はこれまでになかった。したがって、今回決定した一連の結晶構造は、StHKの特異な性質の構造基盤を明らかにするだけでなく、ヘキソキナーゼファミリー全体に関しての知見を与えるものである。
添付資料
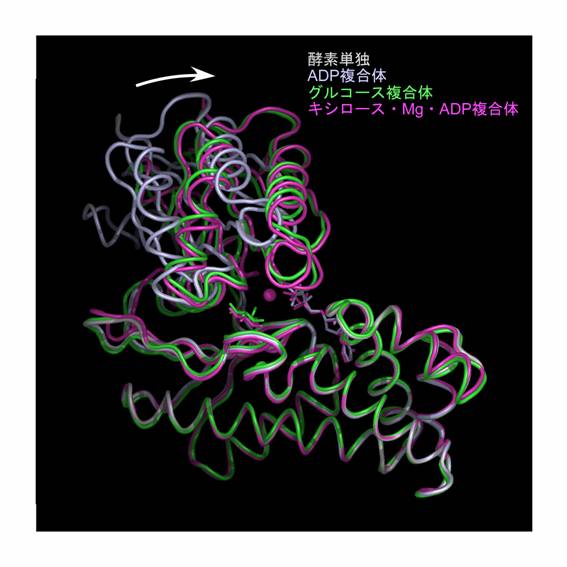
図 StHKの立体構造。4つの状態を異なる色で区別して表示した。大ドメインが重なるように描いてあり、糖基質が結合すると小ドメインが矢印方向に動いて、二つのドメインが閉じる様子がわかる。
http://www.jbc.org/cgi/content/full/282/13/9923
発表雑誌
米国生化学会誌 (Journal of Biological Chemistry) 3/30/2007号に掲載。(Journal of Biological Chemistry, Vol. 282, Issue 13, 9923-9931, March 30, 2007)
用語解説
古細菌:リボソーム小サブユニットのRNAの配列の比較による進化系統樹で、原核生物(核のない生物)でありながら、真正細菌(バクテリア)とは異なるグループに分類される生物の一群で、メタン生成菌・高度好塩菌・好酸好熱菌・超好熱菌など、極限環境に見出されることから、Woeseらが、原始地球環境の生物の末裔と考えて、古細菌(アーケバクテリア、アーケア)と命名したのに基づく。真核生物(核を持つ生物)や真正細菌と比較すると、複製・転写・翻訳などの点で真核生物に類似していたり、古細菌独特の代謝系を持っていたりする点で、進化的に生命の起源に近い位置にあると考えられる。
グルコース(ブドウ糖):生物が最もよく利用する炭素源・エネルギー源であり、細胞内の解糖系路によってピルビン酸にまで代謝されるが、通常は、その初段でグルコースはリン酸化される。
ヘキソキナーゼ:グルコースなどの六炭糖の6位水酸基をリン酸化する酵素。六炭糖のうちグルコースだけを基質とするものはグルコキナーゼと呼ばれる。リン酸供与体として、ATPが働くが、古細菌グルコキナーゼの中には、ADPを用いるものもある。
ドメイン:タンパク質の立体構造のうち、空間的なまとまりをもった一部分。
〒113−8657 東京都文京区弥生1−1−1 www-admin@www.a.u-tokyo.ac.jp
Copyright © 1996- Graduate School of Agricultural and Life Sciences, The University of Tokyo