NAD+還元[NiFe]ヒドロゲナーゼのレドックススイッチ機構の構造基盤の解明 -タンパク質の構造変化による酸素および活性酸素種からの防御機構と生物のエネルギー代謝システムの進化についての基礎科学的研究-
- 発表者
-
庄村 康人(茨城大学大学院理工学研究科/フロンティア応用原子科学研究センター 准教授)
竹田 翠(兵庫県立大学大学院生命理学研究科/次世代水素触媒共同研究センター 研究員)
中島 悠志(兵庫県立大学大学院生命理学研究科/次世代水素触媒共同研究センター 大学院生)
太 虎林(奈良先端科学技術大学院大学物質創成科学研究科 特任助教/(CREST研究員))
中川 英恵(兵庫県立大学大学院生命理学研究科/次世代水素触媒共同研究センター 大学院生)
池田 洋子(兵庫県立大学大学院生命理学研究科/次世代水素触媒共同研究センター 研究員)
石井 正治(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
五十嵐 泰夫(東京大学 名誉教授)
西原 宏史(茨城大学農学部食生命科学科 教授)
尹 基石(九州大学大学院工学研究院/カーボンニュートラル・エネルギー国際研究所 准教授)
小江 誠司(九州大学大学院工学研究院/カーボンニュートラル・エネルギー国際研究所 教授)
廣田 俊(奈良先端科学技術大学院大学物質創成科学研究科 教授/(CREST共同研究者))
樋口 芳樹(兵庫県立大学大学院生命理学研究科/次世代水素触媒共同研究センター 教授/CREST研究代表者,
理化学研究所 客員研究員(研究当時))
発表のポイント
◆研究グループは共同で、大型放射光施設・SPring-8を利用して、酵素の1つあるNAD+還元[NiFe]ヒドロゲナーゼのX線結晶構造解析(立体構造解析)を行った。
◆NAD+還元ヒドロゲナーゼの立体構造解明は、世界初の成果である。
◆今回の研究成果は、酵素の酸素に対する防御機構と細胞における活性酸素種の生成を抑える分子機構の解明に寄与する重要な知見である。また、生物のエネルギー代謝システムの進化的側面を解明した。
発表概要
兵庫県立大学大学院生命理学研究科/次世代水素触媒共同研究センターの樋口芳樹教授(科学技術振興機構CREST研究代表者,理化学研究所客員研究員(研究当時))、茨城大学大学院理工学研究科/フロンティア応用原子科学研究センターの庄村康人准教授、同大学農学部の西原宏史教授、奈良先端科学技術大学院大学物質創成科学研究科の廣田俊教授、東京大学大学院農学生命科学研究科の石井正治教授、九州大学大学院工学研究院/カーボンニュートラル・エネルギー国際研究所の小江誠司教授らの研究グループは共同で、大型放射光施設・SPring-8を利用して、酵素の1つであるNAD+還元[NiFe]ヒドロゲナーゼ(注1)(注2)のX線結晶構造解析(立体構造解析)(注3)を行った。
NAD+還元ヒドロゲナーゼの立体構造解明は、世界初の成果である。NAD+還元ヒドロゲナーゼは、水素酸化還元触媒ユニット(ヒドロゲナーゼ)とNAD+酸化還元触媒ユニット(ジアフォラーゼ)が合体した複合体酵素で、水素とNAD+の酸化還元をカップリングさせることができる。構造解析の結果、分子中の鉄硫黄クラスター(注4)の酸化状態の変化が引き金(レドックススイッチ)(注5)になって酵素の分子構造が変化し、これが酸素に対する防御機構と活性酸素種(注6)の生成を抑える分子機構に関連していることを見出した。また、酵素分子中で電子を流す鉄硫黄クラスターの立体配置が、ヒトを含む酸素呼吸をする生物の呼吸鎖電子伝達系で重要な酵素・複合体Ⅰ(注7)と酷似していることを見出した。
今回の研究成果は、酵素の酸素に対する防御機構と細胞における活性酸素種の生成を抑える分子機構の解明に寄与する重要な知見である。また、生物におけるエネルギー代謝システムの進化的側面を解明した。
本研究は、科学技術振興機構(JST)の戦略的創造研究推進事業(CREST)「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」領域(研究総括:田中啓二 東京都医学総合研究所理事長兼所長)の研究費支援を受けて行われた。
発表内容
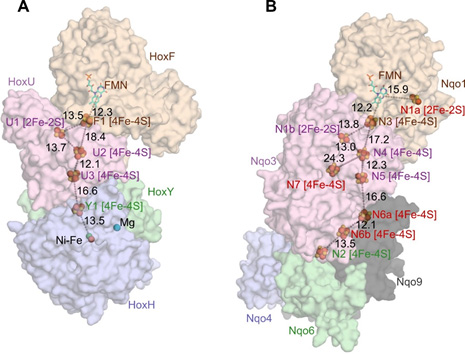
図1 NAD+還元[NiFe]ヒドロゲナーゼ(A)と呼吸鎖複合体I(B)の比較
(拡大画像↗)
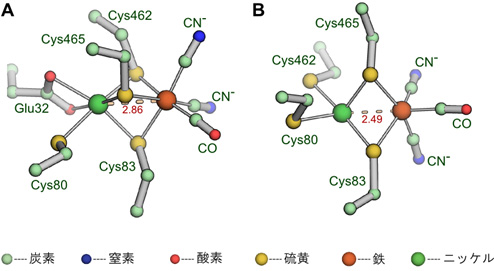
図2 NAD+還元[NiFe]ヒドロゲナーゼの水素酸化還元部位の構造(A:酸化型、B:還元型)
(拡大画像↗)
化石燃料に替わるクリーンエネルギーとして、期待されている水素を利用した燃料電池の原型が考案されたのは19世紀半ばであると言われていますが、太古より多くの微生物は水素から生育に必要なエネルギーを取り出したり、これとは逆に、余剰なエネルギーを水素として放出したりするシステムを獲得して利用してきました。ヒドロゲナーゼとよばれる酵素は、微生物の細胞内で水素の分解(酸化)や合成(プロトンの還元)を行いますが、単独ではたらくことはまれで、その多くは他の物質の酸化還元反応に関与する酵素と合体して1つの複合体として機能しています。今回の研究に用いたNAD+還元[NiFe]ヒドロゲナーゼは、水素酸化還元ユニットとNAD酸化還元ユニットからなり、両酸化還元反応を組み合わせることにより、水素の分解と合成(およびそれにともなうNAD+の還元とNADHの酸化)のどちらも1つで行うことができる珍しいタイプのヒドロゲナーゼです。両ユニットはそれぞれ2つのサブユニット(タンパク質分子)から構成されているので、合計4つのサブユニットからなる複合体分子です。また、このタンパク質は、呼吸鎖複合体Iとよばれる、私たちヒトも含む酸素呼吸を行う全ての生物が持つ重要な膜結合性タンパク質の一部と、アミノ酸配列がよく似ていることが分かっていました。さらに、複合体Iは、老化やガンの原因となる活性酸素種を最も多く作るタンパク質であることも最近の研究で分かってきています。NAD+還元[NiFe]ヒドロゲナーゼは、嫌気呼吸(注8)だけでなく酸素呼吸を行う微生物にも見られることから、活性酸素種の生成に関与する可能性が考えられましたが、その詳細は不明でした。また、光合成生物によって地上の酸素量が増える以前(すなわち複合体Iが出現する以前)の太古の生物もヒドロゲナーゼを持っていたことから、複合体Iとヒドロゲナーゼの進化的関係についても注目されていました。
【研究の成果】
今回、研究グループは、水素酸化細菌Hydrogenophilus thermoluteolus TH-1由来のNAD+還元[NiFe]ヒドロゲナーゼの結晶化に成功し、大型放射光施設SPring-8(注9)の大阪大学蛋白質研究所専用ビームラインBL44XU、JASRI共用ビームラインBL38B1およびBL41XU、ならびに理研専用ビームラインBL32XUを用いてX線結晶構造解析を行いました(図1)。そして、世界初となるこのタンパク質の立体構造解析によって複合体Iとの詳細な構造の比較が可能となりました。NAD+還元[NiFe]ヒドロゲナーゼは、分子中に合計5個の鉄硫黄クラスターと1個のNi-Fe活性部位を持っていました。本酵素に含まれる4つのサブユニットの一つ一つの構造は複合体Iの対応するサブユニットとよく似ていましたが、水素酸化還元ユニットとNAD酸化還元ユニットの位置関係は大きく異なることが分かりました。これに対して、両ユニット間の電子の通り道となる5個の鉄硫黄クラスターの相対配置はよく似ており、両酵素は最も効率のよい電子の通り道を作っていました。このことから,ヒドロゲナーゼの水素酸化還元ユニットと、これに相当する複合体Iのユニットは共通の祖先を持つが、大気に酸素が出現してからはそれぞれ独立に進化を続け、NAD酸化還元ユニットを獲得したことが示唆されました。一方、本酵素の酸化型と還元型の構造の比較によって、酸化型のNi-Fe活性部位(注10)はこれまでに例のない配位構造をとり、酵素が機能を失う原因となる酸素が接近できない構造をとっていることが分かりました(図2)。また、還元型では余剰な還元当量により活性酸素種が発生しないようNAD+還元部位が変形した構造をとっていました。このことにより、本酵素が酸素による失活を防ぐ仕組み(酸素耐性機構)の一端を解明することができました。さらに、両活性部位の構造変化は周囲の鉄硫黄クラスターの電荷の変化とうまく連動しており、鉄硫黄クラスターが単に電子の通り道ではなく、酸化還元状態を感知して構造変化を引き起こすスイッチ(レドックススイッチ)としての役割を持つことを見出しました。
【今後の展望 】
本研究が明らかにした、「ヒドロゲナーゼのNi-Fe活性部位が酸素による攻撃から逃れる仕組み」はこれまでに例がないもので、ヒドロゲナーゼおよびこれに類似する触媒の酸素耐性の一般則の構築など、この問題を克服するための鍵になることが期待されます。また、複合体Iが生成する活性酸素種と老化やガンとの関係が指摘される一方で、活性酸素生成を防ぐ機構については理解が進んでいませんでしたが、今回我々が提唱したNAD+還元[NiFe]ヒドロゲナーゼにおける活性酸素種の生成抑制の分子機構が大きなブレークスルーとなることが期待されます。
発表雑誌
- 雑誌名
- :「Science」8月31日オンライン版
- 論文タイトル
- :Structural basis of the redox switches in the NAD+-reducing soluble [NiFe]-hydrogenase
- 著者
- :Y. Shomura, M. Taketa, H. Nakashima, H. Tai, H. Nakagawa, Y. Ikeda, M. Ishii, Y. Igarashi, H. Nishihara, K-S. Yoon, S. Ogo, S. Hirota, Y. Higuchi
- DOI番号
- :10.1126/science.aan4497
- 論文URL
- : http://science.sciencemag.org/content/357/6354/928.full
問い合わせ先
- 兵庫県立大学大学院生命理学研究科
教授 樋口芳樹
Tel:0791-58-0179
E-mail:hig<at>sci.u-hyogo.ac.jp <at>を@に変えてください。
茨城大学大学院理工学研究科
准教授 庄村康人
Tel:029-352-3239
E-mail:yasuhito.shomura.s<at>vc.ibaraki.ac.jp <at>を@に変えてください。
東京大学大学院農学生命科学研究科 応用生命工学専攻 応用微生物学研究室
教授 石井正治
Tel:03-5841-5142
E-mail:amishii<at>mail.ecc.u-tokyo.ac.jp <at>を@に変えてください。
用語解説
- 注1 NAD
- ニコチンアミドアデニンジヌクレオチドの略称で、地球上のほぼ全ての生物の細胞内の化学反応で電子のやりとりを媒介する分子。多くの酵素に対して酸化還元反応の補酵素としての役割を持つ重要な分子。酸化型はNAD+、還元型はNADHと略称される。
- 注2 [NiFe]ヒドロゲナーゼ
- 多くの微生物が持つ酵素で水素の合成や分解を司る。分子中のNi(ニッケル)とFe(鉄)原子からなる金属 錯体(Ni-Fe活性部位*10)が機能上重要な役割を担う。NAD+還元[NiFe]ヒドロゲナーゼは、[NiFe]ヒドロゲナーゼとNAD酸化還元酵素が合体した酵素である。通常,活性部位に金属をもち、その金属原子の構成により、[NiFe],[FeFe],[Fe]ヒドロゲナーゼと呼ばれる。
- 注3 X線結晶構造解析
- 結晶化させた物質によるX線回折現象を利用して物質の立体構造(原子の配置)を解析する研究手法。タンパク質をX線結晶解析する場合には、目的のタンパク質を細菌や細胞に作らせて抽出・精製し、溶液状態でその溶解度を下げることによって結晶化する。X線は、物質を構成する原子が持つ電子との相互作用によって変化する。従って、回折したX線を観測してある計算を行うことにより物質の電子密度分布を得ることができる。SPring-8などの大型放射光施設で発生するX線を使えば、タンパク質の場合,X線結晶解析法によって1.0~3.0 Å(1 Å = 10-8 cm)分解能の精度で立体構造を解析できる。ここで、1.0 Å分解能とは、1.0 Å(10-8 cm)離れた原子を分離できることを意味する。X線結晶構造解析法では、他の分光学的手法とは異なり、解析に成功すれば分子構造全体を見ることができる。
- 注4 鉄硫黄クラスター
- 酵素が酸化還元をともなう化学反応を触媒するには、効率よく電子のやりとりをする原子団(化合物)が必要である。鉄硫黄クラスターは、そのような目的で酵素などのタンパク質が利用する原子団の1つで、Fe(鉄)原子とS(硫黄)原子が結合した構造を持つ。タンパク質中ではFe原子がシステイン(略称:Cys)とよばれるアミノ酸の側鎖にあるS原子の配位結合により保持されていることが多い。一般に、ヒドロゲナーゼは複数個の鉄硫黄クラスターを持つが、NAD+還元[NiFe]ヒドロゲナーゼは、ジアフォラーゼユニットももち、両者の間で電子のやりとりを行う必要がるため、合計5個の鉄硫黄クラスターを有する。
- 注5 レドックススイッチ
- 細胞内外の酸化還元電位(電子を与えやすいか,受け取りやすいかを示す指標)は、生命活動に関係する化学反応に大きな影響を与える。この酸化還元電位の高低によってそれに関わる分子(例えば酵素)自身が形(立体構造)を変えて特定の化学反応を進めたり抑えたりする仕組みをレドックススイッチと呼ぶ。
- 注6 活性酸素種
- 通常の酸素(O2)と比較して著しく反応性に富む酸素種のことを指す。主としてスーパーオキシドアニオン,ヒドロキシラジカル,ペルヒドロキシラジカルのことを示す。相互に反応して連鎖的に強い酸化作用示すが、生物の細胞内では無差別かつ有害な酸化反応を示すため、癌や老化、さらには種々の疾患の原因の一つと考えられている。
- 注7 複合体Ⅰ
- 酸素呼吸でエネルギー代謝を行う生物の呼吸鎖電子伝達経路における最初の過程で重要な役割を持つ膜結合性タンパク質複合体。膜から飛び出した部分(可溶性部分)が,アミノ酸配列の相同性から、NAD+還元[NiFe]ヒドロゲナーゼと進化的に共通の祖先を持つと考えられていた。
- 注8 嫌気呼吸
- 私たちが住んでいる地上のように酸素濃度が比較的高い場所を好気的環境と呼び、土壌中や腸内など著しく酸素濃度が低い場所を嫌気的環境と呼ぶ。エネルギー代謝において最終電子受容体として酸素を用いる呼吸は酸素呼吸とされる。一方、酸素ではなく、硫酸塩や硝酸塩などを利用する呼吸の総称を嫌気呼吸と呼ぶ。地球表層にまだ十分な酸素がなかった太古の時代の微生物の中には、ヒドロゲナーゼのような酵素を使い、嫌気呼吸によって水素を分解して生命活動に必要なエネルギーを得ているものがいた。
- 注9 大型放射光施設SPring-8
- 兵庫県にある大型共同利用施設。ほぼ光速で進む電子が、その進行方向を磁石などによって変えられると接線方向に赤外線や可視光線、紫外線やX線などを含む電磁波が発生する。これが放射光であり、電子のエネルギーが高く、進行方向の変化が大きいほど、X線などの短い波長を含むようになる。タンパク質など生体高分子の結晶のX線回折データを収集するための実験ビームラインとしては、JASRI共用ビームラインBL38B1およびBL41XU、大阪大学蛋白質研究所専用ビームラインBL44XU、ならびに理研専用ビームラインBL32XU等が利用されている。また、第三世代の大型放射光施設と呼ばれるものには、世界にSPring-8,APS(アメリカ)、ESRF(フランス)などがある。
- 注10 Ni-Fe活性部位
- ヒドロゲナーゼの触媒反応の中心的な役割を担う部分に見られる、Ni(ニッケル)とFe(鉄)原子からなる金属錯体部分を示す。ヒドロゲナーゼ分子中の4個のシステイン残基(アミノ酸の1つ)のS原子がNi原子に配位結合してこのNi-Fe活性部位をタンパク質中に保持している。4個のシステイン残基のS原子のうちの2個はFe原子にも配位しており、Fe原子にはさらにアミノ酸以外の配位子が3個結合し、合計5個の配位子を持つ。活性型の酵素の活性部位にはNi原子とFe原子の両者に基質の水素分子が架橋結合する配位座(配位子が結合する場所)が残されている。一方、酸素(O2)に長くさらされた不活性型酵素では、そこに酸素由来の分子(おそらく-OH)が結合するため、水素は結合できなくなり機能を失う。