生物活性に重要なカルバゾール環の新しい形成機構を解明
- 発表者
- 小林正弥(東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程3年、日本学術振興会特別研究員DC1:当時)
富田武郎(東京大学生物生産工学研究センター 助教)
西山 真(東京大学生物生産工学研究センター 教授)
葛山智久(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
発表のポイント
- 放線菌の生産する抗酸化物質カルキノスタチンAの生合成遺伝子を同定し、そのカルバゾール環の形成機構を明らかにしました。
- このカルバゾール環の形成機構は、放線菌が生産するカルバゾール化合物に普遍的であり、炭素鎖伸長反応と酸化的環化反応を伴う特異な連続反応によるものでした。
- カルバゾール化合物の生合成酵素の合理的な改変・設計により、非天然型カルバゾール化合物の創出や生物活性の向上が期待できます。
発表概要
アルカロイド(注1)は、抗ガン活性や抗酸化作用など多様な生物活性を示すことが知られています。カルキノスタチンA(図1)は、オルトキノンを含む特徴的なカルバゾール環構造を母核とするアルカロイドであり、20年前に放線菌から発見されていたものの、その骨格形成に関わる酵素は未同定でした。
東京大学の葛山教授・西山教授と産業技術総合研究所の新家研究グループ長との共同研究グループは、カルキノスタチンAのすべての生合成遺伝子の同定に成功し、カルバゾール環形成の鍵酵素であるCqsB2を発見しました(図2)。さらにX線結晶構造解析(注2)によりCqsB2の立体構造(図3)を決定し、本酵素の触媒機構の詳細を明らかにしました。カルバゾールは140年前にコールタールから、また生物代謝物としては50年前に同定されていた骨格構造ですが、詳細な生合成メカニズムは未解明でした。本研究で明らかにしたカルバゾールの環化機構はこれまでに報告例がなく、放線菌由来のカルバゾール環を含む天然化合物の環形成機構を明らかにすることで、その普遍性を提唱することができました。
本研究では生合成経路の解明にとどまらず、同定した酵素群を組み合わせることで、新奇のカルバゾール化合物の酵素合成にも成功しました。今後、酵素工学やゲノムマイニング技術(注3)を駆使することで、アルカロイドの構造多様性の創出や生物活性の向上が期待できます。
発表内容
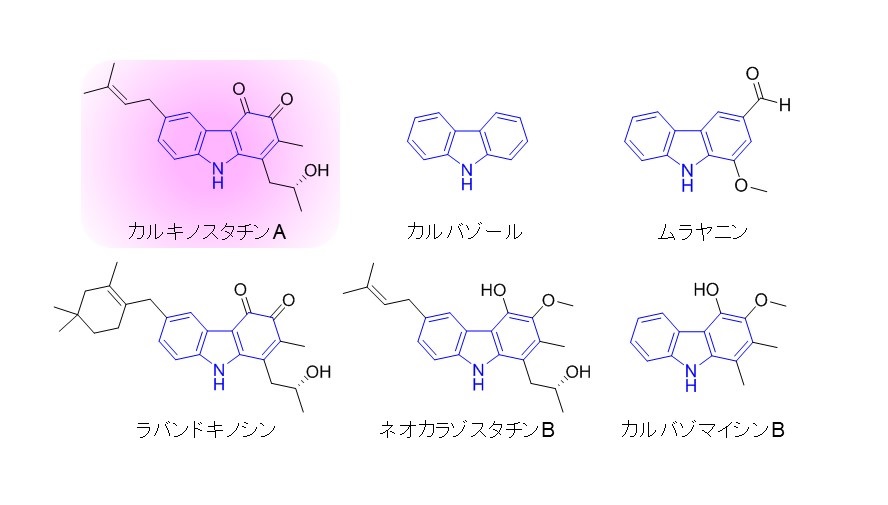
図1 カルバゾールアルカロイドの例
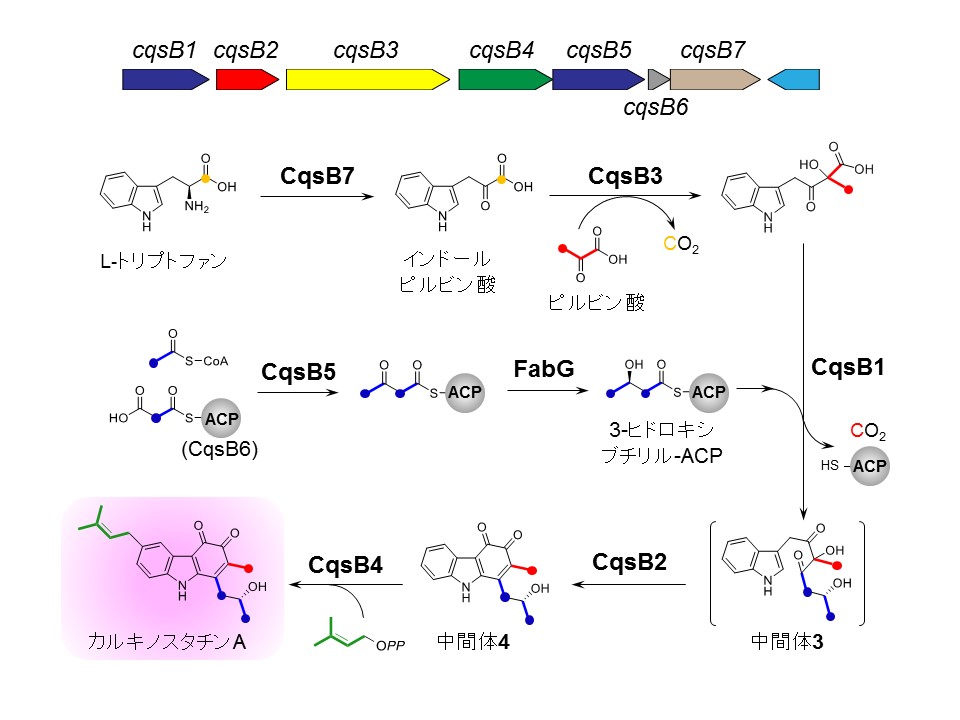
図2 カルキノスタチンAの生合成遺伝子クラスターと生合成経路(生合成遺伝子クラスターの矢印は各遺伝子の長さと向きを表している)
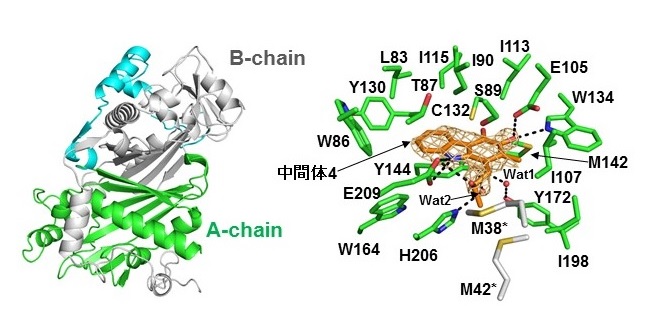
図3 カルバゾール環合成酵素CqsB2の立体構造(左図:全体構造、右図:活性中心)
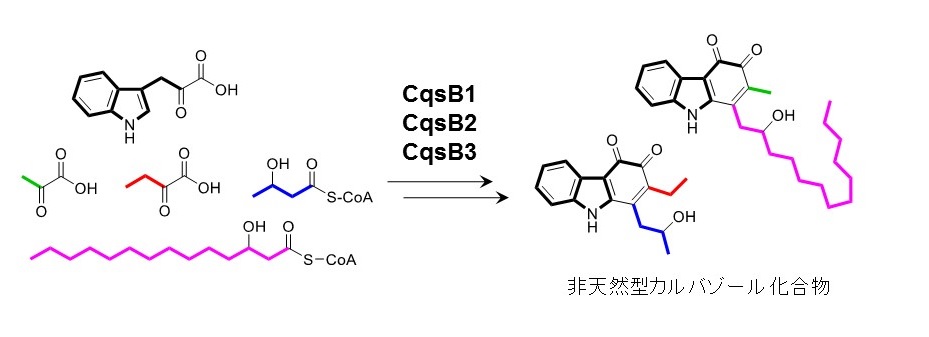
図4 カルバゾール生合成酵素を利用した非天然型カルバゾール化合物の酵素合成
土壌微生物である放線菌は多様な生物活性物質を生産することが知られており、2015年のノーベル生理学・医学賞の対象となったエバーメクチンを筆頭に、人類はそれらを生活向上のために利用してきました。数ある天然化合物の中でも、アルカロイドは多種多様な骨格構造と強力な生物活性を示すことから、創薬資源として利用価値の高い化合物群として知られています。放線菌Streptomyces exfoliatus 2419-SVT2から単離されたカルキノスタチンAは、抗酸化作用を示すカルバゾールアルカロイドです(図1)。本化合物は、細胞内でフリーラジカル消去剤として機能すると考えられており、脳虚血後の神経細胞保護や神経変性疾患抑制のリード化合物として期待されます。
カルバゾールアルカロイドの生合成に関しては、一部のバクテリアで報告例があるものの、カルキノスタチンAのようなオルトキノンを含む特徴的なカルバゾール環の形成機構については知見がありませんでした。そこで我々の研究グループは本化合物に着目し、カルバゾール骨格の構築に関わる興味深い未知酵素の発見を目指して本研究に取り組みました。
研究グループは、次世代シークエンサーによるゲノム解析、異種発現実験に基づく生合成遺伝子クラスターの同定と遺伝子領域の最小化、さらに生合成酵素を使用した生化学的・構造生物学的アプローチにより、カルキノスタチンAの生合成の全容を解明しました(図2)。標識前駆体を用いたラベル実験の結果から、カルバゾール環の炭素骨格は、L-トリプトファン、ピルビン酸、2分子の酢酸に由来することが示唆されていました。各酵素の機能解析を進めた結果、L-トリプトファン由来のインドールピルビン酸、ピルビン酸、および3-ヒドロキシルブチリル-ACPを基質とすることで、CqsB1, CqsB2, CqsB3の全酵素を含む反応系においてカルバゾール生合成中間体4の生成を確認することができました。この結果から、カルバゾール骨格の生合成における一連の増炭反応と閉環反応を上記の3つの酵素が担うことが明らかになりました。特に、CqsB2は閉環反応を触媒し、かつオルトキノンを生成する前例のないカルバゾール環合成酵素であることを明らかにしました。次いで研究グループは、X線結晶構造解析によってCqsB2の立体構造の解明にも成功しました(図3)。CqsB2の三次元構造は、II型ポリケタイド合成酵素のうち環化反応を触媒する酵素と類似の構造であった一方、触媒残基の種類や位置は全く異なっていたことから、その環化メカニズムに興味がもたれました。そこで我々は立体構造および変異体の解析を実施し、その結果に基づきCqsB2の詳細な反応機構を提唱しました。
さらに研究グループは、CqsB1, CqsB2, CqsB3に対して様々な基質を検討し、2つの新規カルバゾール化合物を創出することにも成功しました(図4)。
本研究により、自然界におけるカルバゾール生合成の普遍性、またアルカロイドの生合成機構の多様性の一端を解明することができました。カルバゾールを含むアルカロイド系天然化合物は重要な創薬資源であり、そのような医薬品リード化合物の生合成経路を解明することで、アルカロイドの構造多様性を生み出す多彩な二次代謝経路や酵素反応の理解につながると期待しています。また得られた知見を活用し、新規分子骨格の構築や生物活性の創出にも寄与できると考えています。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業」、文部科学省科学研究費補助金新学術領域研究(研究領域提案型)「生合成リデザイン」(16H06453)、日本学術振興会の科学研究費補助金(15J10131)、A3 Foresight Programの支援を受けて行われました。
発表雑誌
- 雑誌名
- Angewandte Chemie International Edition
- 論文タイトル
- An Unprecedented Cyclization Mechanism in the Biosynthesis of Carbazole Alkaloids in Streptomyces
- 著者
- Masaya Kobayashi, Tomita Takeo, Kazuo Shin-ya, Makoto Nishiyama, and Tomohisa Kuzuyama*
- DOI番号
- 10.1002/anie.201906864
- 論文URL
- https://onlinelibrary.wiley.com/doi/10.1002/anie.201906864
問い合わせ先
東京大学大学院農学生命科学研究科応用生命工学専攻 分子育種学研究室
教授 葛山 智久(くずやま ともひさ)
Tel/Fax:03-5841-3080
研究室URL:http://mcb.bt.a.u-tokyo.ac.jp/
用語解説
- (注1) アルカロイド
インドール環などに由来する窒素原子を含む天然有機化合物の総称。高等植物や真菌類、バクテリアなどの二次代謝産物として2000種類以上が報告されている。アルカロイド系の化合物群は重要な創薬資源であり、血圧降下剤レセルピンや抗癌剤ビンクリスチンは医薬品として利用されている。 - (注2) X線結晶構造解析
タンパク質の結晶にX線を照射して得られる回折データをもとに、立体構造を原子レベルで解析する手法。 - (注3) ゲノムマイニング
遺伝子の情報を手掛かりに、生物のゲノム配列から特定の機能を持つ遺伝子(群)を探し出すこと。

