バイオ医薬品の品質管理に向けた「冬虫夏草」由来の糖鎖切断酵素のメカニズム解明
- 発表者
- 関 陽香 (東京大学大学院農学生命科学研究科応用生命工学専攻 大学院学生;当時)
黄 一博 (九州大学大学院農学研究院 大学院学生;当時)
荒川 孝俊 (東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
山田 千早 (東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
木下 崇司 (株式会社伏見製薬所港町事業所糖質バイオ研究部 主任研究員)
岩本 将吾 (株式会社伏見製薬所港町事業所糖質バイオ研究部 研究員)
樋口 裕次郎 (九州大学大学院農学研究院 助教)
竹川 薫 (九州大学大学院農学研究院 教授)
伏信 進矢 (東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
発表のポイント
- タンパク質に結合した糖鎖を切り離す酵素(ENGase)が、糖鎖の「コアフコース」とタンパク質部分を認識する機構を明らかにしました。
- 哺乳動物の糖鎖に多いとされるコアフコースを特異的に認識して切断する新しいENGaseを冬虫夏草の一種(サナギタケ)から得て、その三次元構造を解明しました。
- ENGaseは糖鎖を切断するだけでなく、転移反応により均一な糖鎖を持つタンパク質を調製できるため、バイオ医薬品(抗体医薬)の品質管理に役立つと期待されています。
発表概要
ENGaseは糖タンパク質のアスパラギン(Asn)残基に結合した糖鎖を切断して遊離する酵素です。これまでいくつかのENGaseの立体構造が報告されており、遊離する糖鎖部分の結合の様子については知見がありました。しかし、切断点よりタンパク質に近い部分、特にAsnに結合したN-アセチルグルコサミン(GlcNAc)と、しばしばそのGlcNAcに付加している「コアフコース」に対して、ENGaseがどのように結合して見分けているかは全くわかっていませんでした。東京大学大学院農学生命科学研究科の関陽香大学院学生と伏信進矢教授らのグループは、九州大学の竹川薫教授および伏見製薬所らのグループと共同研究を行い、X線結晶構造解析により、「冬虫夏草」の1種であるサナギタケから得られた新規なENGaseの立体構造を決定し、コアフコース、GlcNAc、Asnを認識して切断する様子を明らかにしました。コアフコースはヒトなどの哺乳動物の糖鎖に付加されていることが多く、ENGaseは抗体などの糖タンパク質の糖鎖を均一なものにすることができるため、本研究の成果は、近年承認数が急増しているバイオ医薬品(抗体医薬)の性能向上および品質管理などへの応用が期待されます。
発表内容
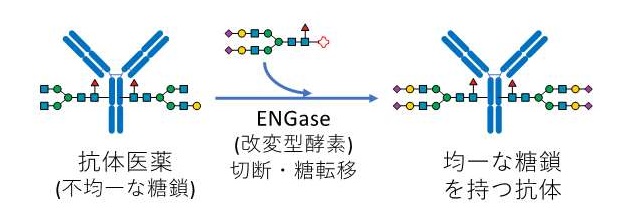
図1 ENGaseを利用した均一な糖鎖を持つ抗体の作成
糖タンパク質である抗体(免疫グロブリン)には不均一なN-結合型糖鎖が結合しているが、ENGaseの改変型酵素であるグライコシンターゼと活性化された糖鎖を利用して糖転移反応を行うことにより、均一な糖鎖を持つ抗体を作ることができる。
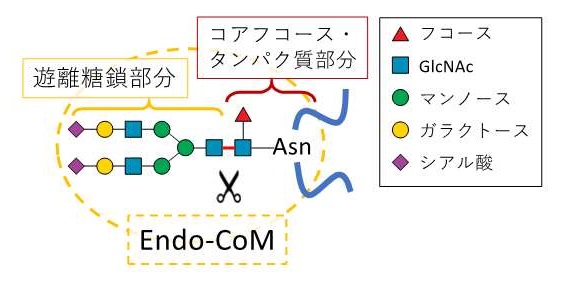
図2 コアフコースに特異的なENGaseであるEndo-CoMの作用の模式図
ENGaseはN-結合型の糖鎖の根元部分に存在する2つのN-アセチルグルコサミン(GlcNAc:青い四角で示した)の間の結合(赤い線で示した)を切断して糖鎖部分を遊離する。Endo-CoMは、コアフコース(赤い三角で示した)を認識し、これが存在する場合に高い活性を示す。
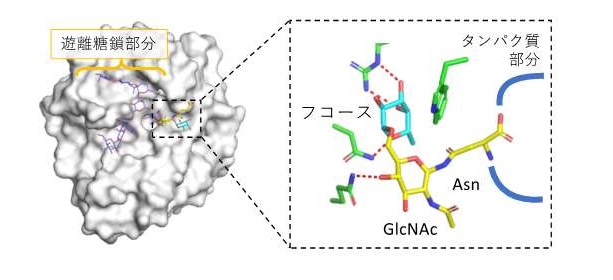
図3 本研究で明らかとなったEndo-CoMの立体構造
Endo-CoMの全体構造を左に、活性中心付近の拡大図を右に示す。本研究では、コアフコース(水色)と、GlcNAcおよびAsn残基(黄色)の結合した立体構造を決定して、それらを認識するEndo-CoMのアミノ酸残基(緑色)や周囲の様子などを明らかにした。コアフコースはそれをぴったりと囲むポケットにより認識されていた。
ENGase(エンド-β-N-アセチルグルコサミニダーゼ;注1)は糖タンパク質のAsn残基に結合したN-結合型糖鎖(注2)の根元に近い部分を切断して、糖鎖の大部分をタンパク質から切り離す(遊離する)酵素です。ENGaseは糖鎖を切り離すだけでなく、グライコシンターゼと呼ばれる改変を加えた酵素と活性化修飾を施した糖鎖を共に用いることで、糖転移と呼ばれる反応により効率よく糖鎖をすげ替えることができるため(注3)、均一な糖鎖を持つ糖タンパク質を作ることが可能となります(図1)。ENGaseのこのような性質は、糖タンパク質である各種の抗体(免疫グロブリンG; IgG)の性能向上にも役立つことが示されており、近年注目が高まっているバイオ医薬品(注4)の品質管理への応用が期待されています。
ヒトなどの哺乳動物のN-結合型糖鎖では、根元のGlcNAcにフコースがα1,6-結合した「コアフコース」が付加しているものが多いことがわかっています。これまでにさまざまな生物からENGaseが得られていますが、①コアフコースが存在する糖鎖には全く作用できないもの、②コアフコースの有無にかかわらず同程度の活性を示すもの、③コアフコースがある場合のみに高い活性を示す「コアフコースに特異性な」もの、があることが知られていました。しかし、それらの酵素の性質の違いがどのような構造的特徴にもとづくのかは、全く不明でした。九州大学の黄一博大学院学生、竹川薫教授らは、2018年に冬虫夏草として知られるキノコの一種であるサナギタケ(Cordyceps militaris)からコアフコースに特異的な新しいENGase(Endo-CoM)を発見しました(図2)。東京大学大学院農学生命科学研究科の関陽香大学院学生、伏信進矢教授らのグループは高エネルギー加速器研究機構物質構造科学研究所の高性能なシンクロトロン放射光実験施設(注5)を利用してEndo-CoMのX線結晶構造解析を行い(注6)、その立体構造を明らかにしました(図3)。特に、これまで報告されていなかったコアフコース、GlcNAc、Asnが結合した状態の立体構造が得られたことから、ENGaseがコアフコースとタンパク質に近い部分をどのように認識しているのか、という長年の疑問にはっきりとした答えが得られました。
今後は、Endo-CoMの立体構造から得られた知見をもとに、コアフコースやタンパク質部分の認識を変化させたENGaseを作り出すなど、バイオ医薬品の性能向上や品質管理に役立つような研究開発が加速すると期待できます。
発表雑誌
- 雑誌名
- 「The Journal of Biological Chemistry」(掲載日:2019年9月23日)
- 論文タイトル
- Structural basis for the specific cleavage of core-fucosylated N-glycans by endo-β-N-acetylglucosaminidase from the fungus Cordyceps militaris
- 著者
- Haruka Seki, Yibo Huang, Takatoshi Arakawa, Chihaya Yamada, Takashi Kinoshita, Shogo Iwamoto, Yujiro Higuchi, Kaoru Takegawa and Shinya Fushinobu*
- DOI番号
- 10.1074/jbc.RA119.010842
- 論文URL
- URL:http://www.jbc.org/content/early/2019/09/23/jbc.RA119.010842
問い合わせ先
東京大学大学院農学生命科学研究科応用生命工学専攻 酵素学研究室
教授 伏信 進矢(ふしのぶ しんや)
Tel:03-5841-5151
Fax:03-5841-5151
研究室URL:URL:http://enzyme13.bt.a.u-tokyo.ac.jp/
用語解説
- 注1 ENGase(エンド-β-N-アセチルグルコサミニダーゼ)
N-結合型糖鎖は、Asnに結合した根元部分に、2つのGlcNAcと3つのマンノースからなるコア構造を持つが、ENGaseはその2つのGlcNAcの間の結合を切断する(図2参照)。結果的に、タンパク質に1つのGlcNAc(およびコアフコース)を残して、糖鎖の大部分がタンパク質から遊離する。 - 注2 N-結合型糖鎖
タンパク質に結合した糖鎖はAsn残基の窒素原子に結合するN-結合型糖鎖と、セリン(Ser)またはスレオニン(Thr)残基の酸素原子に結合するO-結合型糖鎖に大別される。N-結合型糖鎖は、Man3-GlcNAc-GlcNAcの5糖からなるコア構造の先の糖鎖構造の違いにより、ハイマンノース型、複合(コンプレックス)型、混合(ハイブリッド)型、などに分類される。 - 注3 糖転移反応とグライコシンターゼ
糖鎖を切断する酵素(糖質加水分解酵素)には、もともと、他の糖鎖が存在する場合に、それを転移してもとの糖鎖とすげ替える、糖転移反応という活性を持つものがある。グライコシンターゼは、そのような酵素の反応中心に改変を加えた酵素であり、オキサゾリンなどの活性化修飾を施した糖鎖を用いると100%近い高収率で糖転移反応を行うことができる(図1参照)。 - 注4 バイオ医薬品
以前からの主流な医薬品であった低分子薬とは異なり、生物を用いて作られた医薬品。近年、その市場は急増しており、モノクローナル抗体である抗体医薬品が多数承認されている。これまでに承認されている抗体医薬品はすべて免疫グロブリン(IgG)由来の配列を持つ。ENGaseにより均一な糖鎖が付加された抗体は、抗体依存性細胞障害作用(ADCC)や補体依存性細胞毒性(CDC)が向上することが示されている。また、Endo-CoMはIgG由来の抗体医薬品であるリツキシマブに対して活性を持つことが確かめられている。 - 注5 シンクロトロン放射光実験施設
光速近くまで加速した陽電子などの荷電粒子の進行方向を磁石により変えると発生する、極めて「明るい」電磁波(高輝度な放射光)をさまざまな実験に利用する施設。本研究では、茨城県つくば市の高エネルギー加速器研究機構(KEK)物質構造科学研究所(IMSS)の放射光施設(Photon Factory, PF)の構造生物学専用ビームライン(実験施設)を用いた。特に、Endo-CoMの立体構造を解くにあたり、S-SAD法という手法を用いており、同手法のために独自に設計・開発されたビームラインであるBL-1Aを用いた。また、兵庫県佐用郡佐用町の大型放射光施設SPring-8も予備的データ測定に用いた。 - 注6 X線結晶構造解析
酵素などのタンパク質の立体構造を明らかにするための最も一般的な解析方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることができる。

