糖尿病網膜症を悪化させる分子の発見と治療への応用
- 発表者
- 大森 啓介(研究当時:東京大学大学院農学生命科学研究科 獣医学専攻 博士課程4年生)
永田奈々恵(東京大学大学院農学生命科学研究科 応用動物科学専攻 特任研究員)
堰八英里香(東京大学大学院農学生命科学研究科 応用動物科学専攻 修士課程1年生)
村田 幸久(東京大学大学院農学生命科学研究科 応用動物科学専攻 准教授)
発表のポイント
- 糖尿病の合併症である糖尿病網膜症(注1)で観察される、網膜血管内皮の不安定化や炎症細胞の浸潤、それに伴う網膜の浮腫の再現が可能なマウスモデルの確立に成功した。
- 上記モデルマウスの網膜血管内皮において、ケモカイン(注2)であるStromal cell-derived factor-1a(注3)とその受容体であるCXCR4(注3)の発現が上昇していることを発見した。また、CXCR4の血管内皮特異的な遺伝子欠損や、薬の投与による阻害は、この網膜症の症状を改善することを発見した。
- 本研究成果は、SDF-1α-CXCR4シグナルの阻害が、失明リスクのある重篤な疾患である糖尿病網膜症の新しい治療標的となる可能性を示唆するものである。
発表概要
糖尿病有病者とその予備軍は、国内でそれぞれ1000万人にものぼると推定されている。糖尿病で恐ろしいのが合併症であり、その1つの糖尿病網膜症は約140万人が罹患している。
糖尿病網膜症の網膜では、血管を覆う周皮細胞がはがれて炎症細胞が浸潤し、残った血管内皮を刺激して血液を漏れやすくする。これが網膜の出血や浮腫につながり、失明にまで至ることがある。しかし現在、糖尿病網膜症に対する有効な治療法は限られており、新しい治療法の開発が求められてきた。
東京大学大学院農学生命科学研究科の村田幸久准教授と名古屋市立大学大学院医学研究科の研究グループは、①周皮細胞の増殖や活性を妨げる抗体を投与することで、周皮細胞を剥離することにより、ヒト糖尿病網膜症に近いマウスモデルを確立し、②この網膜血管の内皮細胞にStromal cell-derived factor-1α(SDF-1α)と呼ばれる遺伝子の発現が上昇することを発見した。さらに、③SDF-1α受容体であるCXCR4の遺伝子欠損や薬剤による阻害が、周皮細胞剥離による炎症細胞の浸潤や血管内皮の不安定化を抑え、網膜症の症状を改善することを発見した。
これらの成果は、SDF-1α-CXCR4シグナルの阻害が糖尿病網膜症の新しい治療標的になる可能性を示すものである。
発表内容
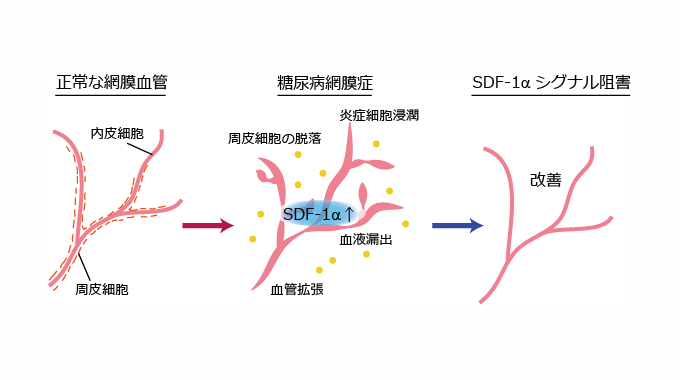 図1 成果のまとめ
図1 成果のまとめ
正常な網膜の血管は内側を覆う内皮細胞と外側を覆う周皮細胞とで構成される。糖尿病網膜症になると、周皮細胞が脱落して不安定な内皮細胞だけが残り、血管拡張して炎症細胞が浸潤し、血液が漏れやすくなる。この時血管内皮細胞からのSDF-1αの産生量が増加していた。このシグナルを遺伝子改変や薬の投与によって抑えると、網膜症の症状が改善する。
研究の背景
糖尿病の有病者(強く疑われるもの)とその予備軍は、国内でそれぞれ1000万人にのぼると推定されている。糖尿病を患った場合、恐ろしいのが三大合併症(網膜症・腎症・神経障害)の発症である。その1つである糖尿病網膜症は、約140万人が罹患しており、これにより年間約3,000人が失明する重篤な疾患である。
糖尿病網膜症が起こると、網膜の血管を覆う周皮細胞が脱落して内側を覆う内皮細胞だけが血管を構成するようになる。この脆弱な血管は拡張や蛇行して、血液成分が漏れやすくなっており、漏れ出た炎症細胞(マクロファージ)が網膜内へ浸潤して、病態をさらに悪化させる。結果として、光を感じる網膜に異常な血管が増えて出血して浮腫などが起こり、失明へとつながる。
現在、患者数が増えつつある本疾患では、血管内皮細胞増殖因子(VEGF)を標的とした、抗体医薬の投与による治療が一部行われているが再発も多く、治療に反応しない患者もいるため、治療法の開発は急務となっている。
本研究は、周皮細胞の脱落から始まるヒトの糖尿病網膜症をマウスで再現し、その進行メカニズムの解明と治療法の開発を目的に行った。
研究の内容
生後1日の新生仔マウスに、抗Platelet-derived growth factor receptor β(PDGFRβ)抗体(注4)を腹腔投与したところ、生後8日の網膜組織において、血管周皮細胞の消失に伴って血管壁が拡張・蛇行し、バリア構造が破綻していた。また、マクロファージの浸潤数も増加した。生後11日には顕著な網膜浮腫や出血が観察され、ヒト糖尿病網膜症と同様の症状を呈していることが分かった。
作製した網膜症モデルの網膜から血管内皮細胞を単離し、遺伝子の発現を解析した結果、網膜症の発症に伴ってケモカインの1つであるStromal cell-derived factor-1α(SDF-1α) の発現が強く誘導されていた。
さらに、網膜組織においてSDF-1αの受容体であるCXCR4が血管内皮細胞に強く発現しており、この数が、抗PDGFRβ抗体の処置(網膜症の進行)により増加することが確認された。
網膜症の進行における、血管内皮細胞のSDF-1α-CXCR4シグナルの役割を評価した。その結果、遺伝子改変技術を用いて血管内皮細胞特異的にCXCR4を欠損させたり、もしくはCXCR4の阻害剤(AMD3100又はFC131)を連日投与(腹腔内もしくは眼投与)すると、抗PDGFRβ抗体処置による網膜血管の拡張やマクロファージの浸潤が有意に抑えられた。また、血漿成分であるフィブリノーゲンの血管外への漏出、網膜の浮腫や出血も緩和された。
上記の様に、網膜に浸潤してきたマクロファージが、サイトカインや増殖因子を多く産生して網膜症をさらに悪化させることが報告されている。抗PDGFRβ抗体の処置により網膜における、マクロファージ遊走因子chemokine (c-c motif) ligand (CCL) 2の遺伝子発現が上昇した。CXCR4阻害剤の投与はこれらの発現をも抑制していた。
結論と意義
抗PDGFRβ抗体投与により作成した糖尿病網膜症モデルにおいて、血管内皮で産生されたSDF-1αはCXCR4受容体を介して網膜組織へのマクロファージの浸潤を促し、網膜症の病態を進行させることが分かった。また、このシグナルの阻害は糖尿病網膜症の新規治療標的として有用である可能性が示された。
発表雑誌
- 雑誌名
- JCI insight
- 論文タイトル
- Inhibition of stromal cell-derived factor-1α/CXCR4 signaling restores the blood-retina barrier in pericyte-deficient mouse retinas
- 著者
- Keisuke Omori, Nanae Nagata, Kaori Kurata, Yoko Fukushima, Erika Sekihachi, Nobutaka Fujii, Tomoko Namba-Hamano, Yoshitsugu Takabatake, Marcus Fruttiger, Takashi Nagasawa, Akiyoshi Uemura, Takahisa Murata
- DOI番号
- 10.1172/jci.insight.120706
- アブストラクト
- https://doi.org/10.1172/jci.insight.120706
問い合わせ先
東京大学大学院農学生命科学研究科 応用動物科学専攻 放射線動物科学教室
准教授 村田幸久(むらた たかひさ)
Tel:03-5841-7247 or 03-5841-5394
Fax:03-5841-8183
E-mail:amurata<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 糖尿病網膜症
糖尿病の三大合併症の1つ。日本における成人の失明原因の上位に位置するが、自覚症状なく進行するため気を付ける必要がある。血糖が高いまま維持されると、網膜の血管を覆う周皮細胞が脱落して内側を覆う内皮細胞だけが血管を構成するようになり、これが詰まったり漏れたりすることで、網膜がダメージをうけて、視覚障害や時 に失明へとつながる
- 注2 ケモカイン
白血球などの遊走を刺激して炎症を促進する蛋白質。サイトカインの1種。
- 注3 Stromal cell-derived factor-1a(SDF-1α)
細胞を遊走させるケモカインの1つで、CXCL12としても知られる。Gタンパク質共役受容体(GPCR)であるC-X-C chemokine receptor type 4(CXCR4)のリガンドとして機能する。SDF-1α- CXCR4シグナルの活性は、発生や白血球の遊走に重要な役割を果たすことが知られている。
- 注4 抗Platelet-derived growth factor receptor β(PDGFRβ)抗体
Platelet-derived growth factor receptor (血小板由来成長因子)βに対する抗体。この抗体を投与すると網膜血管への、血管周皮細胞の遊走や増殖が抑えられる。これにより糖尿病網膜症様の症状を引き起こすことができる。

