肥満を制御する酵素を発見
- 発表者
- 裏出 良博(東京大学医学部附属病院 眼科 特任研究員/北里大学 薬学部 客員教授)
藤森 功(大阪薬科大学 薬学部 病態生化学研究室 教授)
有竹 浩介(第一薬科大学 薬学部 薬品作用学分野 教授)
永田 奈々恵(東京大学大学院農学生命科学研究科 放射線動物科学研究室 特任研究員)
前原 都有子(大阪薬科大学 薬学部 病態生化学研究室 助教)
発表のポイント
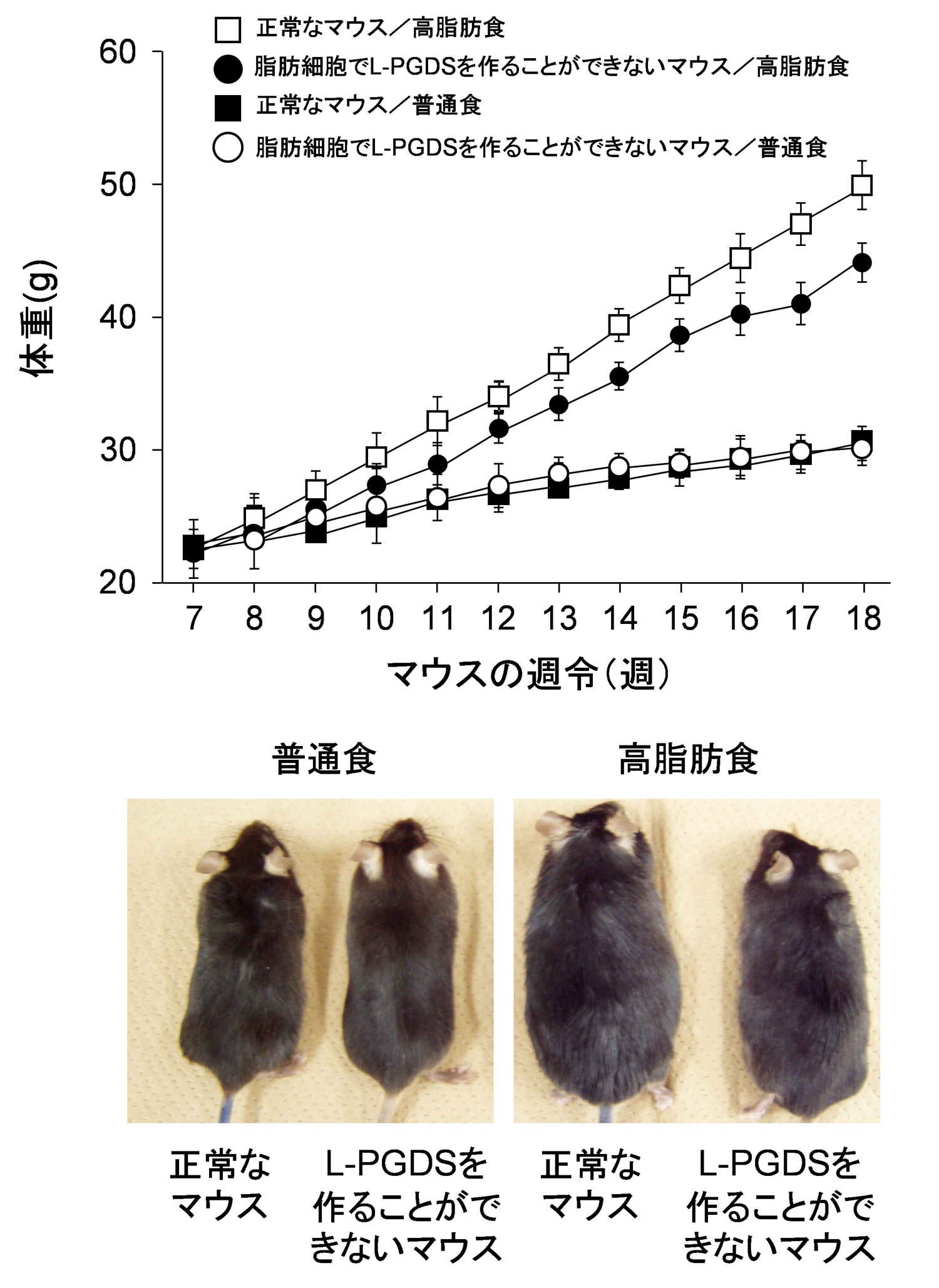
- 脂肪細胞で特異的にプロスタグランジンD2(PGD2)を作ることができないマウスに高脂肪食を与え肥満に対する影響を調べたところ、正常なマウスと比べて体重増加が20%以上減少しました。
- PGD2を脂肪細胞で作ることができないマウスでは、高脂肪食を与えたときに正常なマウスで見られるインスリン感受性が改善されました。
- 本研究成果はPGD2のはたらきを抑制することによる新たな抗肥満薬の開発につながることが期待されます。
発表概要
肥満は糖尿病(インスリン抵抗性糖尿病)、高血圧、脂質異常症など、多くの生活習慣病の原因となることから、肥満の予防や解消は急務の課題となっています。日本の糖尿病有病者数は約1,000万人と推計されていますが[平成28年「国民健康・栄養調査」(厚生労働省)]、特に、肥満が原因となってインスリンが効かなくなり、血糖値が下がらないインスリン抵抗性(注1)糖尿病の患者数は、増加の一途をたどっています。しかし、肥満は複雑に制御されていることから、肥満のメカニズムを解明し、新たな抗肥満薬の開発につながる「肥満調節分子」の発見が期待されています。
肥満では、体の組織に脂質が蓄積するだけでなく、脂質自体が、直接、肥満や生活習慣病の病態の進展に関わることが知られています。脂質の一つであるプロスタグランジンD2(PGD2:注2)とPGD2のL型合成酵素(L-PGDS:注3)が脂肪細胞に蓄積した脂肪の分解の抑制に関わることが発見されています(Biochem. Biophys. Res. Commun. 490: 393, 2017)。
そこで、東京大学、大阪薬科大学、第一薬科大学、筑波大学の研究グループは、肥満制御におけるPGD2のはたらきを調べるため、脂肪細胞でL-PGDSを作ることができないマウスを作製し、肥満におけるL-PGDSのはたらきを解析しました。正常なマウスと脂肪細胞でL-PGDSを作ることができないマウスに11週間、高脂肪食を与えて肥満にさせたところ、脂肪細胞でL-PGDSを作ることができないマウスでは、正常なマウスと比べて体重増加が20%以上減少し、内臓や皮下の脂肪量も減少していました。さらに、糖尿病の指標となるインスリン感受性も改善されていることが分かりました。今回の成果は肥満を調節する新たな酵素の発見であり、この酵素の活性を調節する化合物が抗肥満薬につながることが期待されます。本研究は、日本時間2月13日英国科学誌『Scientific Reports』(オンライン版)に掲載されます。
発表内容
【研究の背景】
肥満は、糖尿病(インスリン抵抗性糖尿病)、高血圧や脂質異常症などの多くの生活習慣病の発症原因となることから、肥満の予防や解消は急務の課題とされています。特に、肥満が原因となってインスリンが効かなくなり、血糖値が下がらないインスリン抵抗性糖尿病の患者数は、増加の一途をたどっています。日本の糖尿病有病者数は約1,000万人と推計されています[平成28年「国民健康・栄養調査」(厚生労働省)]。しかしながら、肥満は複雑に制御されていることから、肥満のメカニズムを解明し、新たな抗肥満薬の開発につながる「肥満調節分子」の発見が期待されています。肥満では、組織に脂質が蓄積するだけでなく、脂質自体が、直接、肥満や生活習慣病の病態の進展に関わることが知られていますが、その制御機構の全貌は解明されていませんでした。
【研究内容】
本研究グループは、これまでにプロスタグランジンD2(PGD2)が脂肪細胞に蓄積した脂肪の分解を抑制することを発見していました(Biochem. Biophys. Res. Commun. 490: 393, 2017)。さらに、PGD2を生合成するL型酵素(L-PGDS)の遺伝子発現が肥満マウスの脂肪組織において上昇することを発見しました。そこで、肥満制御におけるL-PGDSとPGD2のはたらきを調べるために、脂肪細胞で特異的にL-PGDSを作ることができないようにしたマウスを作製して解析しました。正常なマウスと脂肪細胞でL-PGDSを作ることができないマウスに11週間、普通食あるいは高脂肪食を与えたところ、普通食では両者に肥満の程度や脂肪細胞の大きさに差は現れないものの、高脂肪食を与えたときには、脂肪細胞でL-PGDSを作ることができないマウスでは、正常なマウスと比べて体重増加が20%以上減少し、内臓や皮下の脂肪量も減少し、個々の脂肪細胞の大きさも小さくなっていました(図1)。また、脂肪細胞の分化の程度を知るさまざまなマーカー遺伝子や脂肪酸の生合成に関わる多くの遺伝子の発現は、脂肪細胞でL-PGDSを作ることができないマウスで、いずれも低下していました。血液中のコレステロール、脂質、グルコースの値は、正常マウスと比べて、脂肪細胞でL-PGDSを作ることができないマウスでは低下しており、これらメタボリックシンドロームで異常となる血液中の値も改善されていることが分かりました。また、肥満の脂肪組織にはマクロファージが浸潤し、炎症状態になることが知られていますが、脂肪細胞でL-PGDSを作ることができないマウスでは、炎症を誘導するマクロファージのマーカー遺伝子であるF4/80やCD11cの発現レベルが低下しており、糖尿病の指標となるインスリン感受性も改善されていることが分かりました。
【社会的意義】
肥満の進展を調節する酵素であるPGD2を作るL型酵素(L-PGDS)を脂肪細胞で作ることができないようにしたマウスでは、食事による体重増加が抑制され、インスリン感受性が改善されたことから、L-PGDSが肥満、さらにインスリン抵抗性を進展させるはたらきがあることが明らかとなりました。L-PGDSのはたらきを抑える薬剤は、肥満の新しい予防法や治療法の開発につながることが期待されます。
発表雑誌
- 雑誌名
- Scientific Reports
- 論文タイトル
- L-PGDS-produced PGD2 in premature, but not in mature, adipocytes increases obesity and insulin resistance
- 著者
- Ko Fujimori*, Kosuke Aritake, Yo Oishi, Nanae Nagata, Toko Maehara, Michael Lazarus, Yoshihiro Urade
- DOI番号
- 10.1038/s41598-018-38453-y
- 論文URL
- https://www.nature.com/articles/s41598-018-38453-y
問い合わせ先
東京大学医学部附属病院 眼科
特任研究員 裏出 良博(うらで よしひろ)
Tel:03-3815-5411(内線33490)
E-mail:yurade-tky<アット>umin.ac.jp <アット>を@に変えてください。
大阪薬科大学 薬学部 病態生化学研究室
教授 藤森 功(ふじもり こう)
Tel:072-690-1215
E-mail:fujimori<アット>gly.oups.ac.jp <アット>を@に変えてください。
東京大学大学院農学生命科学研究科 応用動物科学専攻 放射線動物科学研究室
特任研究員 永田 奈々恵(ながた ななえ)
Tel:03-5841-7247
Fax:03-5841-8183
E-mail:anagata234<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 インスリン抵抗性
インスリンによる血糖値の低下作用が現れにくいため、血糖値を正常範囲にするために過剰な量のインスリンを必要とする状態のことである。我が国では、数千万人に上るインスリン抵抗性の糖尿病の患者および予備軍がいるとされる。インスリン抵抗性の主な原因は内臓脂肪の蓄積であり、内臓脂肪の蓄積による炎症性サイトカインの分泌増加、アディポカインの分泌異常などによりインスリンの作用が異常となる。 - 注2 プロスタグランジンD2(PGD2)
プロスタグランジン(PG)は炭素数20個からなる化合物で、さまざまな生理活性をもつことから生理活性脂質といわれる。プロスタグランジンには化学構造の異なる複数の種類が存在するが、中でも生理的に重要なPGD2は、これまでに睡眠の誘発やアレルギーの増悪化などの作用を有することが知られている。 - 注3 PGD2のL型合成酵素(L-PGDS)
PGD2を作る酵素にはH型とL型の2種類があり、それぞれ同じ酵素反応を触媒するが、立体構造や組織分布が異なる。L型酵素は脳、心臓、脂肪組織などに分布して、睡眠や動脈硬化、脂質代謝に関与する。