寄生虫に感染したマクロファージが自己赤血球を貪食する機構と意義
- 発表者
- 森本 彩子(東京大学 大学院農学生命科学研究科 応用動物科学専攻 博士課程学生(当時))
内田 和幸(東京大学 大学院農学生命科学研究科 獣医学専攻 准教授)
チェンバーズ ジェームズ(東京大学 大学院農学生命科学研究科 獣医学専攻 助教)
佐藤 開(東京大学 大学院農学生命科学研究科 応用動物科学専攻 博士課程学生)
洪 婧(東京大学 大学院農学生命科学研究科 応用動物科学専攻 博士課程学生)
三條場 千寿(東京大学 大学院農学生命科学研究科 応用動物科学専攻 助教)
松本 芳嗣(東京大学 大学院農学生命科学研究科 応用動物科学専攻 教授)
山岸 潤也(北海道大学 人獣共通感染症リサーチセンター 准教授)
後藤 康之(東京大学 大学院農学生命科学研究科 応用動物科学専攻 准教授)
発表のポイント
- 寄生虫の一種であるリーシュマニアは、マクロファージによる赤血球の貪食を誘導します。
- この感染誘導性赤血球貪食に関わる分子として、自己認識受容体SIRPαを同定しました。
- また、赤血球貪食はマクロファージ内での原虫の生存を有利にすることがわかりました。
発表概要
寄生虫性疾患である内臓型リーシュマニア症(VL:注1)の患者では、骨髄やリンパ節のマクロファージ(Mφ:注2)によって自己の赤血球が高頻度で貪食される現象が見られます。しかしながら、そのメカニズムや病態の形成に与える影響は分かっていませんでした。これまでに、東京大学大学院農学生命科学研究科博士課程学生(当時)森本彩子および後藤康之准教授らの研究グループは、ヒトで見られる感染誘導性赤血球貪食を動物モデルにて再現することに成功していました。同グループはこの度、リーシュマニア感染自体がMφによる赤血球貪食誘導に十分なことを明らかにしました。また、感染によって赤血球貪食が亢進したMφでは、自己細胞の貪食を抑制する受容体であるSIRPαの発現が低下していることを明らかにしました。さらに、Mφによる赤血球貪食は原虫の生存にとって有利であることが分かりました。「原虫が宿主細胞を自身の生存に好適な環境に改変する」という今回の発見は、免疫学的に非常に興味深いだけでなく、SIRPαの発現を制御することで原虫の増殖と症状の両方を抑えるといった内臓型リーシュマニア症の新たな治療法につながるが期待できます。
発表内容
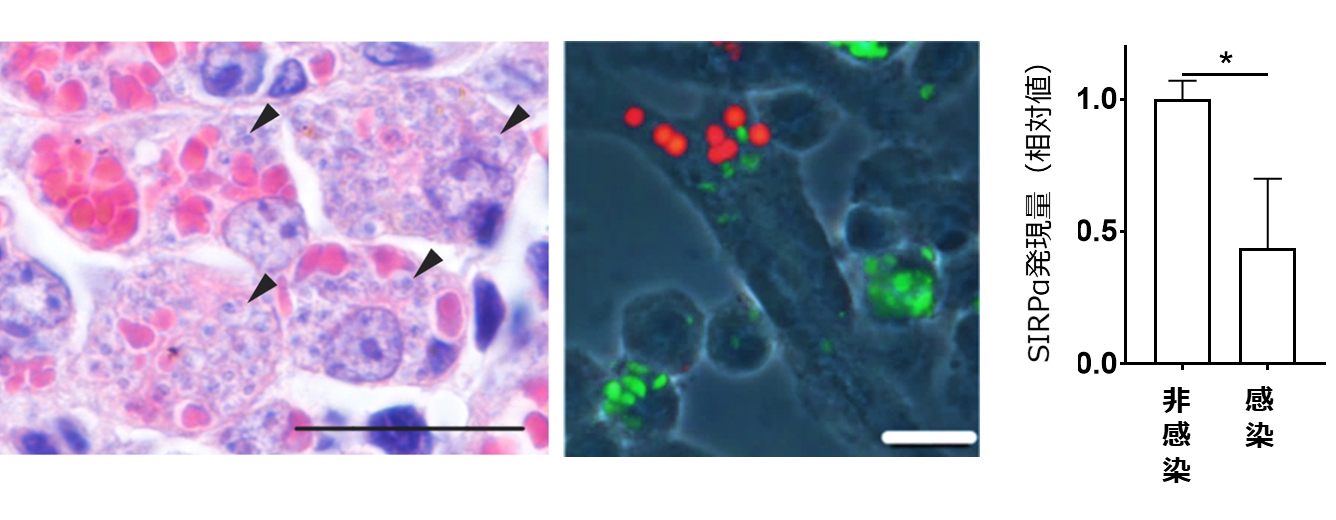
図1 リーシュマニア原虫感染によるMφの赤血球貪食亢進。左:原虫感染マウス脾臓で観察される赤血球貪食Mφ。中央:In vitroでMφに原虫(緑色)を感染させることで赤血球(赤色)の貪食誘導を再現。右:原虫感染により低下したMφのSIRPα発現量。
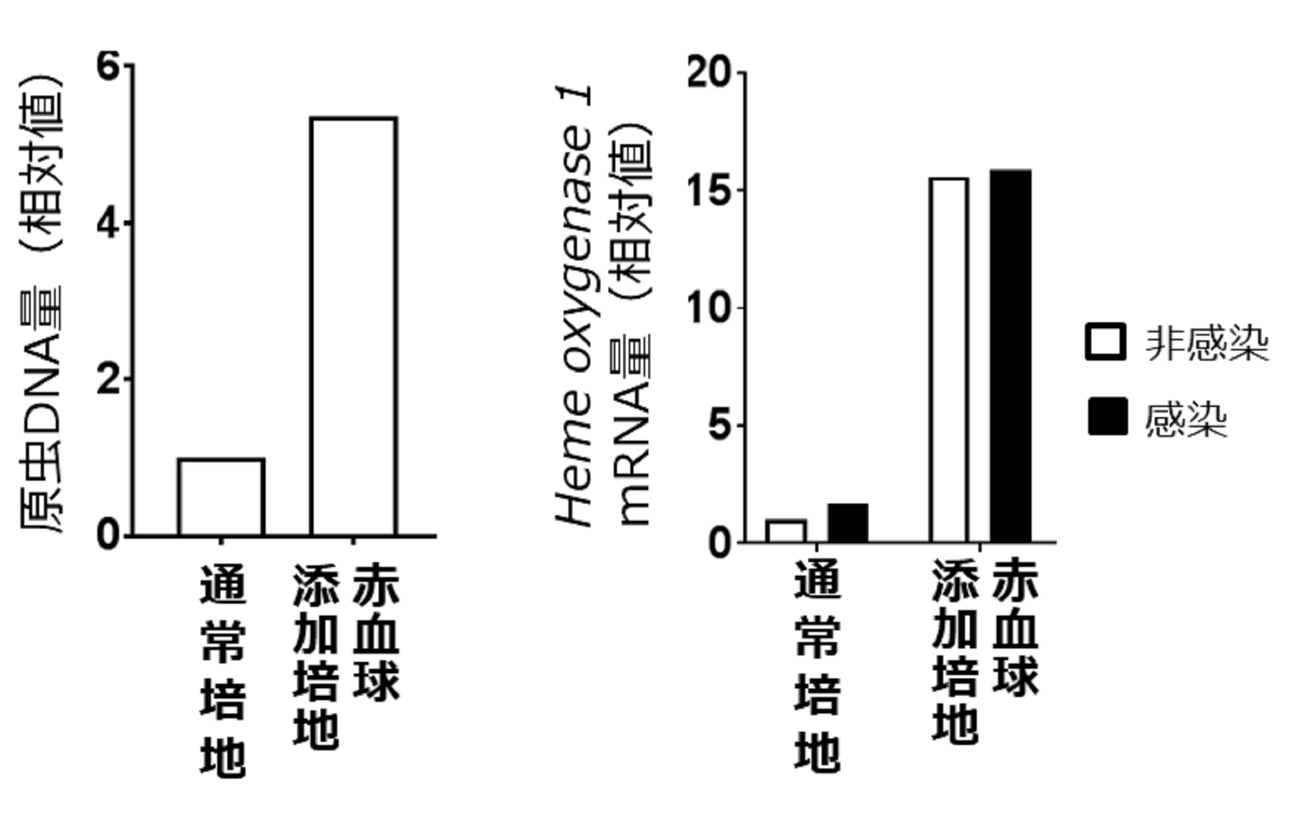
図2 Mφ内リーシュマニア原虫の発育を支える赤血球貪食。左:赤血球存在下で培養したMφ内の原虫数は非添加群と比較して高い値を示す。右: Mφにおける抗酸化物質Hmox1の発現は赤血球の添加により増加する。
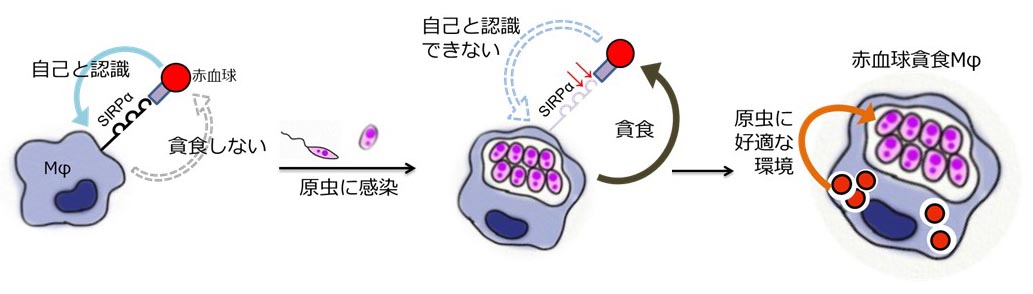
図3 リーシュマニア原虫感染がもたらすMφによる赤血球貪食の概念図
赤血球は、ヒトでは作られてから約120日、マウスでは約30日のサイクルで寿命を迎え、老化した赤血球は脾臓細網内皮系のMφにより貪食・消化されます。通常であれば造血と破壊のバランスが取れていますが、通常より高頻度で赤血球の貪食が起こり、結果として貧血がおきたり重症化して死に至る場合があります。この異常な赤血球貪食は、赤血球自体に生じた異常によるものや、免疫細胞の過度な活性化によるものなど様々な要因によるとされますが、そもそも詳細な発生機序が分かっていない場合も多くあります。
貧血はVL症患者の90%以上で見られます。後藤准教授らの研究グループでは、リーシュマニア原虫感染により貧血を呈するマウスモデルを作成して、その病態形成機序の研究を行っています。これまでに、原虫感染により貧血を呈するマウスの脾臓では赤血球の貪食が亢進していることや、赤血球貪食は原虫に感染したMφにおいてのみ見られることを報告してきました(図1左;Morimoto et al., 2016, PLoS NTDs)。しかしながら、原虫に感染したMφがどのようにして赤血球貪食能を得るのか、そして原虫感染により誘導された赤血球貪食が原虫の生育にどのような影響を与えるのかについては不明でした。そこで、まずin vitroにおいて原虫感染Mφによる赤血球貪食を再現することに取り組みました。培養Mφに正常マウス由来の赤血球を加えたところ、非感染のMφでは赤血球の貪食がおこらないのに対して、原虫を感染させたMφでは赤血球貪食が亢進しました(図1中央)。このことは、原虫感染による赤血球貪食の亢進は感染によって赤血球に生じた異常によるものではなく、Mφに生じた異常であることを示唆しています。
前述のとおりMφは老化赤血球を貪食しますが、逆に正常な赤血球の貪食は抑制される必要があります。このしくみの一つとして、Mφの細胞膜上に発現するSIRPα(注3)が赤血球表面の分子と認識することによって生じる貪食抑制シグナルが知られています。そこで、in vitroにおいて原虫感染したMφにおけるSIRPαの発現を解析したところ、非感染Mφより低下することが分かりました(図1右)。次に、in vivoにおいて赤血球貪食が亢進している脾臓の感染MφによるSIRPαの発現を解析したところ、in vitroの結果と同様にSIRPαの発現低下が見られました。これらの結果は、感染MφではSIRPαの発現が低下することにより貪食抑制シグナルが弱くなり、赤血球を自己細胞と認識する機構が破綻することを示唆しています。
このようにリーシュマニア原虫は感染したMφによる自己細胞認識を改変しますが、原虫自身に対してどういう影響をもたらすのかという疑問が出てきます。感染Mφによる赤血球貪食が内部にいる原虫の生育に与える影響を調べるために、感染Mφに赤血球を貪食させた際の原虫数について解析しました。すると、赤血球を添加したMφ内では、無添加のMφ内に比べて感染後の原虫数が高く(図2左)、感染Mφによる赤血球貪食は細胞内原虫の生存に有利な影響を与えることが明らかとなりました。感染マウスの脾臓においても赤血球貪食細胞では多数の原虫が観察されますが、これらの結果は生体内においても原虫感染によるMφの赤血球貪食亢進が原虫自身に有利に働いていることを示唆しています。赤血球貪食細胞内で原虫が生存しやすくなる機構については、赤血球を貪食することにより生じた抗酸化物質により細胞内の酸化ストレスが低減されて(図2右)原虫の排除が阻害される、あるいは赤血球分解後に生ずる物質を原虫が生存に利用しているなどの理由が考えられ、今後の研究により明らかにしていく必要があります。
以上のことから、VLにおける赤血球貪食は、原虫が感染したMφの自己認識機構を破綻させることに起因して、自身のMφ内生存に有利な環境をもたらしているということが明らかになりました(図3)。本研究は、感染により宿主細胞が寄生虫の生存に有利に働くように改変されるというVL病態の新たな理解につながることに加え、SIRPαの発現を制御することで原虫の増殖と症状の両方を抑えるといった内臓型リーシュマニア症の新たな治療法につながるが期待できます。また、本研究の成果はVLに限らず他の疾患を原因とする赤血球貪食の機序を理解する一助となります。現在、血球貪食症候群の治療には主に免疫抑制剤が用いられていますが、感染症が一次要因である場合には効果的とはいえません。感染誘導性の赤血球貪食に関わる分子を理解することは、副作用の少ない新しい分子標的薬を用いた赤血球貪食治療法の開発につながることも期待されます。
本研究は日本学術振興会、日本医療研究開発機構、武田科学振興財団による支援を受けて実施されました。
発表雑誌
- 雑誌名
- 「PLOS Neglected Tropical Diseases」(オンライン版の場合:2019年11月18日)
- 論文タイトル
- Hemophagocytosis induced by Leishmania donovani infection is beneficial to parasite survival within macrophages
- 著者
- Ayako Morimoto, Kazuyuki Uchida, James K. Chambers, Kai Sato, Jing Hong, Chizu Sanjoba, Yoshitsugu Matsumoto, Junya Yamagishi, Yasuyuki Goto
- DOI番号
- 10.1371/journal.pntd.0007816
- 論文URL
- https://doi.org/10.1371/journal.pntd.0007816
問い合わせ先
東京大学大学院農学生命科学研究科 応用動物科学専攻 応用免疫学研究室
准教授 後藤 康之(ごとう やすゆき)
Tel:03-5841-7569
E-mail:aygoto<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 内臓型リーシュマニア症
リーシュマニア原虫の感染によって引き起こされる寄生虫性疾患で、インド、ブラジル、エチオピアなどの熱帯地域で年間5万人を超える発症者と2万人以上の死者をもたらしています(世界保健機構、2016年)。典型的な症状として発熱、肝脾腫、体重減少、貧血などが挙げられ、治療しないと90%以上が死に至るとされています。 - 注2 マクロファージ(Mφ)
白血球の一つで、病原体など異物を貪食・消化する働きを持つ免疫細胞であり、大食細胞ともよばれます。死細胞やウィルス感染細胞に発現する分子を認識して貪食を行う一方で、自分と同じMHCやCD47などを有する自己細胞は貪食しません。リーシュマニア原虫が哺乳類宿主の体内に侵入した際には、原虫の宿主細胞としても機能します。 - 注3 SIRPα
SIRPαは自己細胞の貪食を抑制する受容体であり、Mφなどの免疫細胞に発現しています。赤血球表面に発現するCD47と結合することで貪食抑制シグナルが形成され正常赤血球の貪食が抑制されている一方、がん細胞ではそのしくみを利用して免疫回避を行っています。つまり、SIRPαの発現を適切に調整することで様々な免疫関連疾患の制御が可能になると考えられ、実際に抗SIRPα抗体を用いたがん治療などが研究されています。

