真核生物初のピロロキノリンキノン依存性脱水素酵素の立体構造を決定
- 発表者
- 武田 康太(東京農工大学グローバルイノベーション研究院 特任助教)
石田 卓也(宇宙航空研究開発機構有人宇宙技術部門 きぼう利用センター 研究員)
吉田 誠(東京農工大学 農学研究院 教授)
鮫島 正浩(東京大学大学院農学生命科学研究科生物材料科学専攻 教授 : 研究当時/現 信州大学工学部特任教授、東京大学名誉教授)
大野 弘幸(東京農工大学 学長)
五十嵐 圭日子(東京大学大学院農学生命科学研究科生物材料科学専攻 准教授)
中村 暢文(東京農工大学大学院 工学研究院生命機能科学部門 教授)
発表のポイント
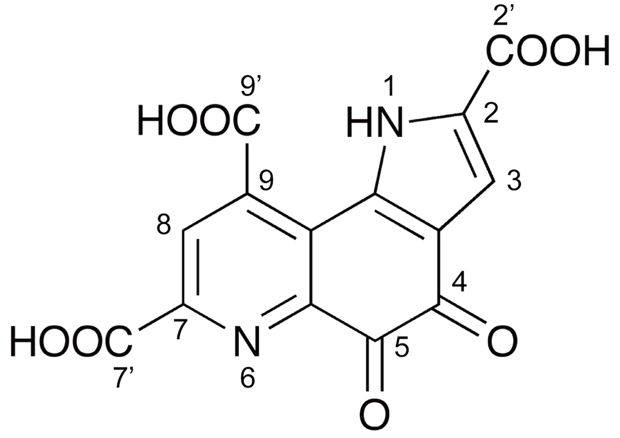
図1 PQQの化学構造
右上のピロール環(五角形部分)と、下部左のピリジン環(六角形部分)に挟まれたオルトキノン 骨格を有し、オルトキノン部位(4、5位)で酸化還元反応が起こる。
- 真核生物由来のピロロキノリンキノン(PQQ、図1) 注1依存性ピラノース脱水素酵素注2の立体構造を明らかにしました。
- X線結晶構造解析注3により、PQQが酵素活性部位に結合していることが確認され、真核生物においてPQQを補酵素とする酵素の存在が始めて証明されました。
- シトクロムドメイン注4の構造解析に成功し、きのこの木材腐朽過程における本酵素の働きについて新たな知見を得ることができました。
発表概要
大学院農学生命科学研究科生物材料科学専攻の五十嵐圭日子(きよひこ)准教授の研究チームは、東京農工大学グローバルイノベーション研究院の武田康太博士と同大学院工学研究院の中村暢文教授の研究チーム、東京農工大学農学研究院の吉田誠教授の研究チームおよび宇宙航空研究開発機構有人宇宙技術部門きぼう利用センターの石田卓也博士との共同研究により、きのこから発見されたPQQ依存性ピラノース脱水素酵素(CcPDH)のPQQ結合ドメイン立体構造を1.3 Åの解像度で明らかにしました。
本酵素の活性中心にPQQが結合している様子が確認され、真核生物で初のPQQ依存性酵素であることが証明されました。PQQ依存性ピラノース脱水素酵素は、糖の酸化を触媒する酵素で、触媒反応が起こるPQQ結合ドメインに加えて、シトクロムドメインが連なったマルチドメイン構造となっています。本発表ではPQQ結合ドメインに加えてシトクロムドメインの立体構造も2.0 Åの分解能で決定することに成功しました。
2014年に、同共同研究チームは真核生物であるきのこから本酵素を見出し、生化学的な解析結果からPQQ依存性である可能性を示しておりました参考文献1。今回のX線結晶構造解析による構造学的な証拠をもって、真核生物由来のピラノース脱水素酵素がPQQを補酵素とする酵素であることを直接証明することに成功しました。担子菌類(きのこ)だけでなく子嚢菌類(カビ)も類似の酵素を生産することが知られていますが、これまで真核生物においてPQQの生合成の経路が発見されていません。つまり、きのこやカビは、細菌類が生産するPQQを“借りて”この酵素を使っていると考えられ、今後「PQQを介したきのこと細菌の共生系」に関する研究に発展することが期待されます。
発表内容
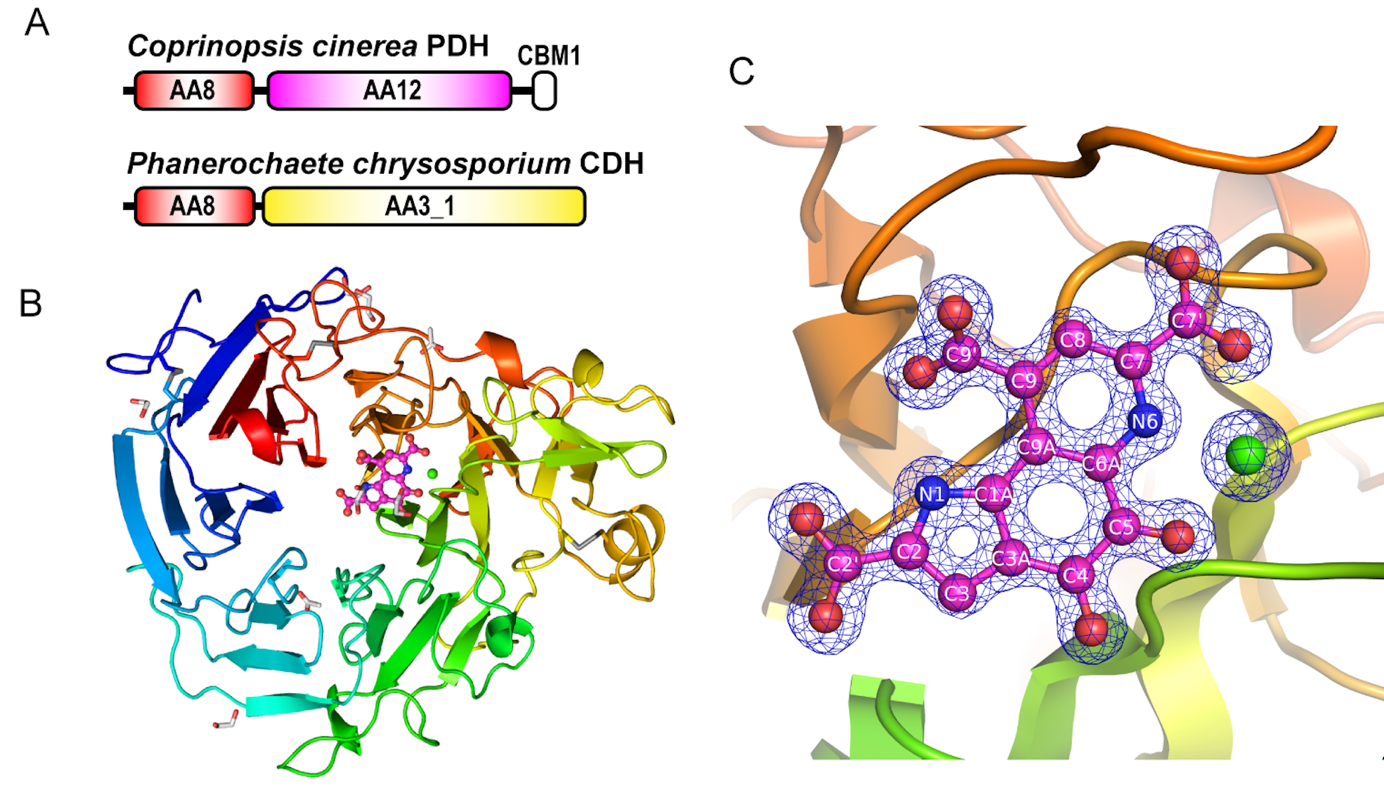
図2
A ドメイン構造の模式図。きのこの一種であるCoprinopsis cinerea由来ピラノース脱水素酵素(上)と、Phanerochaete chrysosporium由来セロビオース脱水素酵素(下)で、両者とも同じファミリーに属するシトクロムドメインを有している。
B Coprinopsis cinerea由来ピラノース脱水素酵素のPQQドメインの全体構造。バレルの中心付近にあるピンク色で表示された部分がPQQ。
C 活性中心のPQQ(ピンク)とカルシウムイオン(緑)。青メッシュで部分は実際に観測された分子の電子密度を表している。
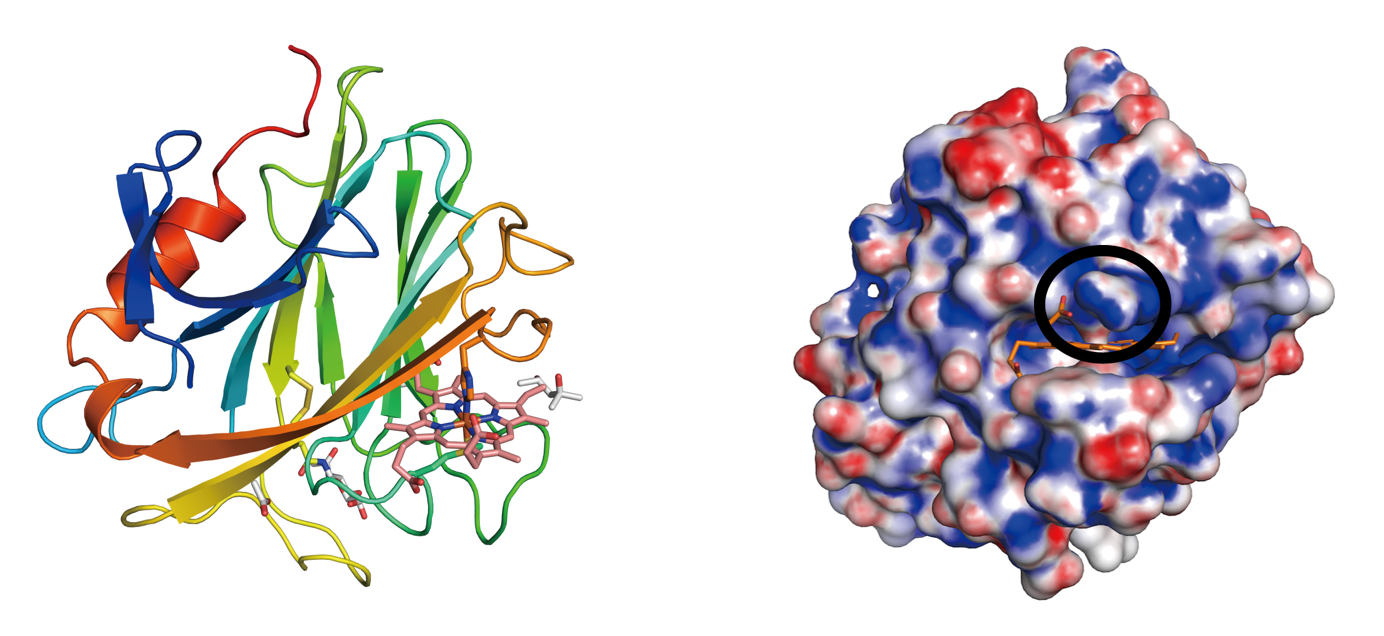
図3 Coprinopsis cinerea由来ピラノース脱水素酵素のシトクロムドメインの全体構造(左)と表面電荷(右)。青が正に荷電した部位で赤が負に荷電した部位を表している。サークルでハイライトした部分がヘムプロピオン酸を相互作用しているアルギンニン残基で、ドメイン間電子移動に関与していることが推測された。
PQQはフラビン、ニコチンアミドに次ぐ第三の補酵素として知られるキノン系化合物です。1964年に細菌のグルコース脱水素酵素から発見されて以来、いくつかのPQQ依存性酵素が原核生物において明らかとなっていました。その後、哺乳類における薬理的な効能や栄養学的な重要性を示すことが報告されたため、新規ビタミンである可能性が議論されましたが、真核生物におけるPQQを補酵素とする酵素の情報がなかったため、その議論はそれ以降進められませんでした。そのような中で、2014年に東京大学と東京農工大学の共同研究チームは、担子菌Coprinopsis cinerea(ウシグソヒトヨタケ)から真核生物由来で初となるPQQ依存性ピラノース脱水素酵素を発見しました。これまで、生化学実験とその分光学的特徴から本酵素の活性にPQQが必要であることは示されてきました参考文献2が、酵素が直接PQQと結合しているかどうかは不明なままでした。また、本酵素はPQQ結合ドメインに加えて、糸状菌に特徴的にみられるシトクロムドメインとセルロース結合性ドメインを有したマルチドメインな酸化還元酵素です(図2A)が、シトクロムドメインを介して、セルロースを酸化的に分解する溶解性多糖モノオキシゲナーゼ(LPMO)注5へと電子供与できることも明らかとなっています参考文献3。
本共同研究チームは、PQQ依存性酵素であることの構造学的な証明と、その機能を理解するために、本酵素の立体構造を決定することに試みました。PQQドメインとシトクロムドメインを切り離して個別に結晶化することで、X線結晶構造解析法を用いてそれぞれの3次元的な構造を明らかにしました。PQQドメインの全体的な立体構造は細菌由来のPQQ依存性グルコース脱水素酵素と似た6枚羽根のスーパーバレル構造をとっていました(図2B)。既知の細菌由来の配列と比較して、アミノ酸配列の相同性は低い(20%弱)ですが、構造相同性を表すRMSD値も2.3 Åと低かったことから、立体構造はかなり類似していることがわかりました。
PQQ分子が結合したホロ体では、PQQはバレルの中心からややずれたところに位置して、カルシウムイオンと共に酵素活性部位に結合していました(図2C)。PQQの結合様式もまた細菌由来の既知酵素のものと類似していましたが、既知酵素のPQQの結合残基とは異なるアルギニン残基がPQQの結合に関与していることが明らかとなりました。さらにこのアルギニン残基は、担子菌類由来の酵素に特徴的であることもわかりました。さらに、活性に必須となるカルシウムイオンの配位も細菌由来の酵素と類似していましたが、やはり結合している残基は異なることが確認されました。加えて、構造が既知の細菌由来の酵素おいて三次構造安定化に寄与すると考えられているカルシウムイオンは、本酵素にはみられませんでした。基質ポケットを形成するループ注6部分に明確な違いがあることがわかり、きのこ由来のPQQドメインの基質ポケットを形成するループが、既知酵素には保存されていないことが確認されました。
シトクロムドメインの立体構造は、逆平行βシートからなるサンドイッチ構造を有し、セロビース脱水素酵素(CDH)注7のシトクロムドメインと非常に類似した全体構造をとっていることがわかりました。CDHのシトクロムドメインは糸状菌に特徴的なヘムタンパク質で、ピラノース脱水素酵素でも同様にbタイプのヘムがメチオニンとヒスチジンを軸配位子として結合していることが確認されました。一方でヘムポケット周辺のアミノ酸残基にはいくつかの違いがみられ、特にヘムのプロピオン酸近傍に存在するアルギニン残基によって部分的に正の表面電荷となっていることがわかりました(図3)。これまでの生化学的な解析も踏まえて、この表面電荷が、ピラノース脱水素酵素のpH依存的なドメイン間電子移動反応の重要な因子となっていることが示唆されました。この結果はタンパク質間電子移動反応と分子認識機構の理解を深める構造的基盤となることが期待されます。
本研究の一部は、日本学術振興会科学研究費補助金若手研究(B)(17K17703 武田康太)、基盤研究(B)(15H04526 研究代表者:吉田誠、研究分担者:五十嵐圭日子)、基盤研究(B)(18H02252 研究代表者:五十嵐圭日子)、文部科学省新学術領域研究(研究領域提案型)(18H05494 研究代表者:五十嵐圭日子)、およびフィンランド卓越教授プログラム(五十嵐圭日子)の補助を受けたものです。
参考文献
1) Matsumura, H., Umezawa, K., Takeda, K., Sugimoto, N., Ishida, T., Samejima, M., Ohno, H., Yoshida, M., Igarashi, K., and Nakamura, N., Discovery of a eukaryotic pyrroloquinoline quinone-dependent oxidoreductase belonging to a new auxiliary activity family in the database of carbohydrate-active enzymes, PLoS ONE 9: e104851 (2014)
2) Takeda, K., Matsumura, H., Ishida, T., Samejima, M., Ohno, H., Yoshida, M., Igarashi, K., and Nakamura, N., Characterization of a novel PQQ-dependent quinohemoprotein pyranose dehydrogenase from Coprinopsis cinerea classified into auxiliary activities family 12 in carbohydrate-active enzymes, PLoS ONE 10: e0115722 (2015)
3) Várnai, A., Umezawa, K., Yoshida, M., Eijsink, V.G.H., The pyrroloquinoline-quinone dependent pyranose dehydrogenase from Coprinopsis cinerea drives lytic polysaccharide monooxygenase action, Appl. Environ. Microbiol. 84: e00156-18 (2018)
発表雑誌
雑誌名:「Applied and Environmental Microbiology」85巻24号e01692-19(オンライン版:10月11日)
本誌85巻24号の注目論文(Spotlight Selection)に選ばれました。
論文タイトル:Crystal structure of the catalytic and cytochrome b domains in a eukaryotic pyrroloquinoline quinone-dependent dehydrogenase
著者:*Kouta Takeda(武田康太)、*Takuya Ishida(石田卓也)、Makoto Yoshida(吉田誠)、Masahiro Samejima(鮫島正浩)、Hiroyuki Ohno(大野弘幸)、†Kiyohiko Igarashi(五十嵐圭日子)、†Nobuhumi Nakamura(中村暢文)
*共同筆頭著者、 †責任著者
DOI番号:10.1128/AEM.01692-19
アブストラクトURL:https://aem.asm.org/content/85/24/e01692-19.abstract
問い合わせ先
東京大学 大学院農学生命科学研究科 生物材料科学専攻 森林化学研究室
准教授 五十嵐 圭日子(いがらし きよひこ)
Tel:03-5841-5258
携帯番号:090-4432-3711
Fax:03-5841-5273
E-mail:aquarius<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
注1 ピロロキノリンキノン
脱水素酵素の補酵素として1964年にその存在が初めて確認され、1979年にメタノールで生育する細菌のメタノール脱水素酵素から単離されて、その化学構造が同定されました。微生物や植物の生育促進、動物においても抗酸化作用など様々な生理作用を示すことが報告されています。過去にヒトのビタミンの可能性も議論されましたが、これまでのところヒトからはPQQを補酵素とする酵素は発見されておりません。
注2 ピラノース脱水素酵素
ピラノース(六員環構造を構成する単糖)の水素を引き抜いて酸化する反応を触媒する酵素の総称です。糸状菌ではフラビンを補酵素とするピラノース脱水素酵素がよく知られていますが、本発表では、最近発見されたPQQを補酵素とするピラノース脱水素酵素の立体構造を決定しました。
注3 X線結晶構造解析
結晶試料にX線を照射し回折データを解析することにより、結晶中のタンパク質分子の立体的構造を原子レベルで決定する手法。精度の高い構造決定のためには質の良い結晶が求められます。
注4 シトクロムドメイン
シトクロムは酸化還元能を有するヘムタンパク質の総称です。呼吸鎖での電子伝達の重要な役割を担い、生体のエネルギー生産に関わっています。ピラノース脱水素酵素やセロビオース脱水素酵素ではシトクロムドメインとして電子伝達に関わる重要な機能を果たしています
注5 溶解性多糖モノオキシゲナーゼ(LPMO)
セルロースやキチンを酸化的に分解する酵素。活性中心に一つの銅イオンを含み、酸素分子の還元的活性化によって生成する活性酸素種を用いて、C-H結合への酸素化反応を行います。
注6 ループ
決まった二次構造(αヘリックスやβシート等)をとらず、二次構造をつなぐ部分をループと呼びます。
注7 セロビオース脱水素酵素
きのこやカビがバイオマスを分解する際に生産する酸化還元酵素の一種で、セルロースがセルラーゼによって分解されたときにできるセロビオース(グルコースがβ-1,4結合した二糖)の還元性末端を酸化する酵素です。

