フィリピンハリナシミツバチ由来プロポリスの胃癌を対象とした抗腫瘍効果の検討
- 発表者
- Mark Joseph M. Desamero(東京大学大学院農学生命科学研究科獣医学専攻 博士課程)
角田 茂(東京大学大学院農学生命科学研究科獣医学専攻 准教授)
湯 玉蘭(東京大学大学院農学生命科学研究科応用動物科学専攻 博士課程)
チェンバーズ ジェームズ(東京大学大学院農学生命科学研究科獣医学専攻 助教)
内田 和幸(東京大学大学院農学生命科学研究科獣医学専攻 准教授)
Maria Amelita C. Estacio(フィリピン大学ロスバニョス校獣医学部 教授)
Cleofas R. Cervancia(フィリピン大学ロスバニョス校教養学部生物科学研究所 名誉教授)
小南 友里(東京大学大学院農学生命科学研究科水圏生物科学専攻 特任助教)
潮 秀樹(東京大学大学院農学生命科学研究科水圏生物科学専攻 教授)
中山 淳(信州大学医学部 教授)
中山 裕之(東京大学大学院農学生命科学研究科獣医学専攻 教授)
久和 茂(東京大学大学院農学生命科学研究科獣医学専攻 教授)
発表のポイント
- プロポリスはミツバチが作り出すワックス(蜜蝋)で、ハチの種類と植生により異なるものの、多彩な生理活性を持つことが知られています。
- 今回検討したプロポリスは大変ユニークなフィリピン固有種のハリナシミツバチ(Tetragonula biroi, Friese)由来のものであり、その機能性・有用性評価を行うフィリピン大学との国際共同研究プロジェクトです。
- 特徴の異なるヒト胃癌細胞株4種を用いたin vitro試験、および分化型胃癌を発症している疾患モデル動物(A4gnt欠損マウス)を用いたin vivo試験により、プロポリスの効果を検証しました。
- プロポリスは分化型胃癌の腫瘍細胞に対して強力な増殖抑制作用を持ち、疾患モデル動物においても抗腫瘍効果が期待出来ることを明らかにしました。
発表概要
プロポリスは、ミツバチが木の芽や樹液、あるいはその他の植物源から集めたワックス(蜜蝋)です。フィリピン大学ロスバニョス校との国際共同研究として、極めてユニークなフィリピン固有種のハリナシミツバチ(Tetragonula biroi, Friese)から得られるプロポリスの抗腫瘍効果について、培養細胞および疾患モデル動物を用いて機能性評価を行いました。
特徴の異なるヒト胃癌患者由来細胞株を用いた実験から、プロポリスには分化型胃癌の性質を持つ胃癌細胞にのみ、強い増殖抑制が見られ、細胞周期のG1期停止の指標となるp21分子の強い発現増加が認められました。そこで、分化型胃癌の疾患モデル動物であるA4gnt KOマウスを用いて生体における検討実験を行いました。分化型胃癌を自然発症したステージのA4gnt KOマウスに対してプロポリスを30日間毎日経口投与したところ、胃癌は対照と比較して退縮しており、病変局所において有意な増殖細胞の減少およびp21陽性細胞の増加が認められました。
これらの実験結果から、フィリピンプロポリスは分化型胃癌においては癌細胞の細胞周期をG1期停止に誘導して増殖を低下させることにより、効果的に胃癌の進展を抑制しうることが明らかになりました。
発表内容

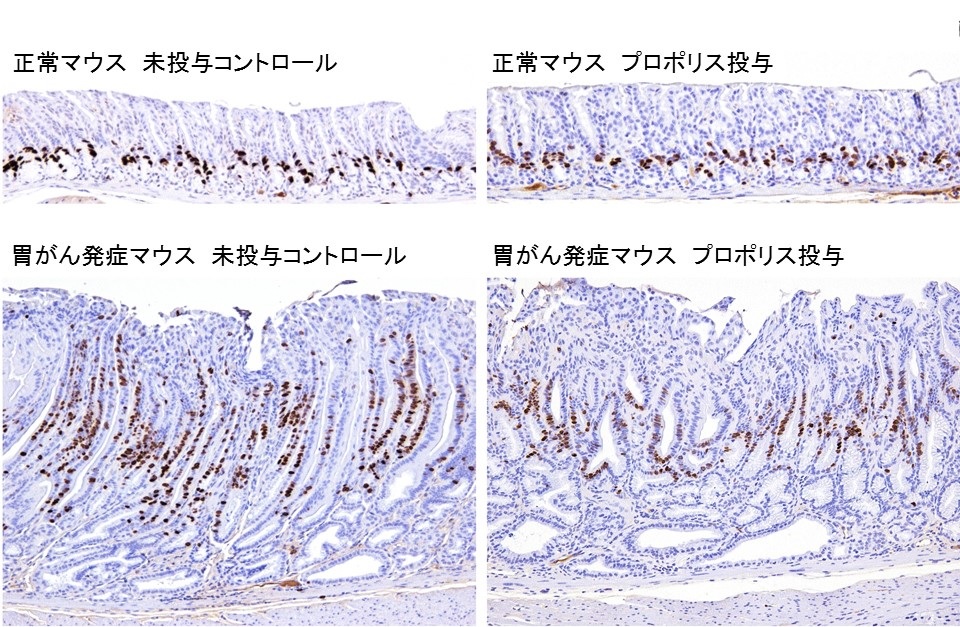
図の説明
(上段)フィリピン固有種のハリナシミツバチTetragonula biroi Frieseおよびプロポリス採取の様子(写真提供:Peter Cervancia氏)。
(下段)胃の組織像。疾患モデル動物A4gnt KOマウスに自然発症した分化型胃癌における細胞増殖(核が茶色に染まっている)は、プロポリス投与により有意に減少しました。
プロポリスは、ミツバチが木の芽や樹液、あるいはその他の植物源から集めたワックス(蜜蝋)です。人類のプロポリス利用の歴史は長く、古くは古代エジプトにてミイラを作る際の防腐剤として利用されていたと言われています。近年、プロポリスが持つ様々な生物活性が評価され、健康食品(サプリメント)や飲料としての利用が拡大し続けています。しかしながら、プロポリスはその起源となる植物およびミツバチの種類により含有成分が大きく異なり、極めて多様性に富む混合物です。フィリピン大学ロスバニョス校(UPLB)(注1)では、極めてユニークなフィリピン固有種のハリナシミツバチ(Tetragonula biroi, Friese)から得られるハチミツやプロポリスは一般的なミツバチから得られるものと比べて強い生物活性を持つことを見出していました。
そこで我々はUPLBとの国際共同研究として、70%エタノールで抽出したT.biroi Friese由来プロポリスの抗腫瘍効果について検討を行いました。まず、特徴の異なる4つのヒト胃癌患者由来細胞株(AGS, MKN-45, NUGC-4, MKN-74)を用いたin vitro実験を行いました。培養液の中にプロポリスを添加したところ、分化型胃癌(注2)の性質を持つ3種類(AGS, MKN-45, NUGC-4)にのみ、強い増殖抑制が見られ、細胞周期のG1期停止の指標となるp21(CIP1/WAF1)(注3)の強い発現増加が認められました。続いて、分化型胃癌の疾患モデル動物(注4)であるA4gnt KOマウス(注5)を用いてin vivo検討実験を行いました。分化型胃癌を自然発症したステージの60週齢のA4gnt KOマウスあるいは同週齢の野生型マウスに対して、100mg/kg体重の容量でプロポリスを30日間毎日経口投与しました。そうしたところ、プロポリスを摂取したA4gnt KOマウスの胃癌は対照と比較して退縮しており、胃粘膜上皮の肥厚の程度が有意に減少し、病変局所での有意な増殖細胞の減少が認められました。加えて、in vitro実験の結果と同様にp21分子を発現する細胞の有意な増加が認められました。
これらのヒト培養細胞と疾患モデル動物を用いた検討から、フィリピンプロポリスは分化型胃癌においては癌細胞の細胞周期をG1期停止に誘導して増殖を低下させることにより、効果的に病態進行を抑制しうることが明らかになりました。
なお、プロポリスは樹脂混合物であり、様々な有機化合物が含まれています。ガスクロマトグラフィー質量分析法にて成分分析を行ったところ、今回用いたフィリピンプロポリスには、これまで報告されていた別種のプロポリス(ハチの種類や産地が異なる)とは違ったスペクトルの有機化合物が含まれていることがわかりました。今後、抗腫瘍作用を示す有効成分の分子実態を追求し明らかにするとともに、分化型胃癌以外の疾患に対しても効果があるのか、培養細胞(in vitro実験)と疾患モデル動物(in vivo実験)の実験系を組み合わせながら検討していきたいと考えています。
謝辞
本研究は、公益財団法人飯島藤十郎記念食品科学振興財団(平成29年度外国人留学生研究助成)および公益財団法人小林国際奨学財団(平成30年度研究助成)の支援を受けて行われました。
発表雑誌
- 雑誌名
- Scientific Reports
- 論文タイトル
- Tumor-suppressing potential of stingless bee propolis in in vitro and in vivo models of differentiated-type gastric adenocarcinoma.
- 著者
- Mark Joseph Desamero, Shigeru Kakuta*, James Kenn Chambers, Kazuyuki Uchida, Maria Amelita Estacio, Cleofas Cervancia, Yuri Kominami, Hideki Ushio, Jun Nakayama, Hiroyuki Nakayama, Shigeru Kyuwa
- DOI番号
- 10.1038/s41598-019-55465-4
- 論文URL
- http://www.nature.com/articles/s41598-019-55465-4
問い合わせ先
東京大学大学院農学生命科学研究科 獣医学専攻 実験動物学研究室
准教授 角田 茂(かくた しげる)
Tel:03-5841-5037
Fax:03-5841-8186
E-mail:akakuta<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 フィリピン大学ロスバニョス校(UPLB)
フィリピン共和国を代表する国立大学であるフィリピン大学の中で、ルソン島中部のラグナ州ロスバニョスにキャンパスがあり、農学部や獣医学部などが設置されています。近年、フィリピンにおける養蜂産業の振興を目的として大学が主体となって“UPLB Bee Program”を組織し、技術講習会などを行いつつミツバチの学術研究を推進しています。 - 注2 分化型胃癌
胃癌を組織学的に分類した際、腺管構造が明瞭なものを分化型、不明瞭なものを未分化型としており、両者でその性質が大きく異なります。そのため、臨床の現場では治療方針を決定する上で重要な指標となります。 - 注3 細胞周期
ひとつの細胞が分裂により2つの細胞となる過程に起こる一連の事象を細胞周期と呼びます。「G1(Gap1)期→S(合成)期→G2(Gap2)期」よりなる間期とM(分裂)期に大別されます。p21(CIP1/WAF1)タンパク質は強力なサイクリン依存性キナーゼ阻害因子であり、G1期における細胞周期進行の調節因子として機能しています。p21タンパク質の強い発現はG1期停止の指標となります。 - 注4 疾患モデル動物を用いたin vivo検討実験
動物を用いた生体での実験をin vivo実験といい、培養細胞などを用いた試験管内実験(in vitro)と対比されます。in vitro実験では対象とする細胞種が限られること、代謝反応後の物質の効果は反映されないなど不十分であることから、被験物質の生体における作用を調べるにはin vivo実験が優れています。ただし、適切な疾患モデル動物を適切な実験条件および方法で使用する必要があります。 - 注5 A4gnt KOマウス
α1,4-N-アセチルグルコサミン転移酵素をコードするA4gnt遺伝子を欠損したマウス。α1,4-N-アセチルグルコサミン転移酵素は、粘液を構成するO型糖鎖の非還元末端に存在するα1,4-N-アセチルグルコサミン残基の生合成に関与します。α1,4-N-アセチルグルコサミン残基は腺胃の腺粘膜と十二指腸のブルンネル腺に特異的であり、この糖鎖を欠損したA4gnt KOマウスでは、胃に過形成・異形成を経て、最終的に分化型胃癌を自然発症することから、胃癌の疾患モデルマウスとして利用されています。実際、我々の研究グループは、A4gnt KOマウスを用いて海藻由来多糖類・βグルカン(ラミナラン)の胃上皮細胞異形成抑制作用の検討を行い、当サイトにて研究成果として発表しました(https://www.a.u-tokyo.ac.jp/topics/2018/20180514-1.html)。
なお、ヒト分化型胃癌においても、α1,4-N-アセチルグルコサミンの消失は予後不良因子であることが知られています。

