天然チオペプチド骨格の簡便で合理的な設計~天然物資源からの創薬研究がより簡便にスピーディーに~
- 発表者
- Alexander A. Vinogradov(東京大学大学院理学系研究科 化学専攻 特任助教)
下村 杜人(東京大学大学院農学生命科学研究科 微生物潜在酵素(天野エンザイム)寄付講座 修士課程大学院生(研究当時))
後藤 佑樹(東京大学大学院理学系研究科 化学専攻 准教授)
尾﨑 太郎(東京大学大学院農学生命科学研究科 微生物潜在酵素(天野エンザイム)寄付講座 特任助教(研究当時))
浅水 俊平(東京大学大学院農学生命科学研究科 微生物潜在酵素(天野エンザイム)寄付講座 特任講師)
菅井 佳宣(東京大学大学院農学生命科学研究科 微生物潜在酵素(天野エンザイム)寄付講座 特任助教(研究当時))
菅 裕明(東京大学大学院理学系研究科 化学専攻 教授)
尾仲 宏康(東京大学大学院農学生命科学研究科 微生物潜在酵素(天野エンザイム)寄付講座 特任教授)
発表のポイント
- 天然チオペプチド(注1)の合成が、人工合成した短いDNA遺伝子を試験管内に投入するだけで、煩雑な操作無しに一日で可能となる手法を確立しました。
- 投入する遺伝子配列を変更することで、アミノ酸配列の異なるさまざまなチオペプチドを簡便に創出できます。
- 天然チオペプチドの構造多様性を超越する92種類の人工チオペプチドの合成に成功しました。この技術を用いることにより、今後新しい生物活性をもった薬剤開発への応用が期待されます。
発表概要
東京大学大学院農学生命科学研究科 尾仲宏康特任教授、東京大学大学院理学系研究科 菅裕明教授らのグループは、新しい医薬品の原料となり得る、微生物が生産する天然物の一種であるチオペプチド化合物群(注1)を試験管内で無生物的に簡便に多種類合成できる手法を開発しました。
チオペプチド化合物群は、抗生物質をはじめとした医薬品にも利用されている重要な化学物質です(図1)。人類はこれまでの長い歴史の中でさまざまな感染症に悩まされてきています。古くはペスト、結核など人類の平均寿命を縮める原因となった感染症は数多くあります。それに対して人類は、青カビの生産する抗生物質であるペニシリンの発見以降、結核の特効薬ストレプトマイシンなど、さまざまな天然物由来抗生物質を開発し、感染症を制圧してきました。しかしながら、現時点でもコロナウイルスを始め、新たな感染症が続々と発生しており、それに対する薬剤の開発が急務となっています。薬剤開発において重要な問題の一つは新たな薬剤となり得る候補化合物を多数取りそろえることですが、天然物に頼る現状では候補化合物の種類に限界があります(注2)。一方、化学合成法を用いて複雑な構造の化合物を多数合成することも行われていますが、構造が複雑になればなるほどコストと時間がかかり、天然物のような複雑な化学構造を容易に作ることが難しいという問題があります。
今回の技術は、複雑な化学構造を持つチオペプチド群を放線菌(注3)が生産する合成過程を試験管内で完全に再現したことです(図2)。この結果、無生物的に簡便に短時間でチオペプチドを合成することに成功しました。さらに、この技術を用いて、微生物には合成できないような非タンパク質性アミノ酸(注4)を組み込んだチオペプチドを初めとして、計92種類の類縁体の合成にも成功しました。この技術は天然物の構造多様性を広げる技術であり、薬剤開発における中核技術となることが期待されます(図3)。
発表内容
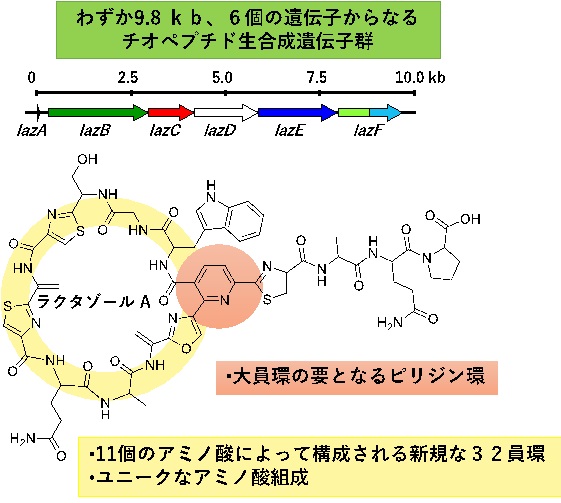
図1 チオペプチド化合物の一種・ラクタゾールの化学構造とその生合成遺伝子群・lazA遺伝子群
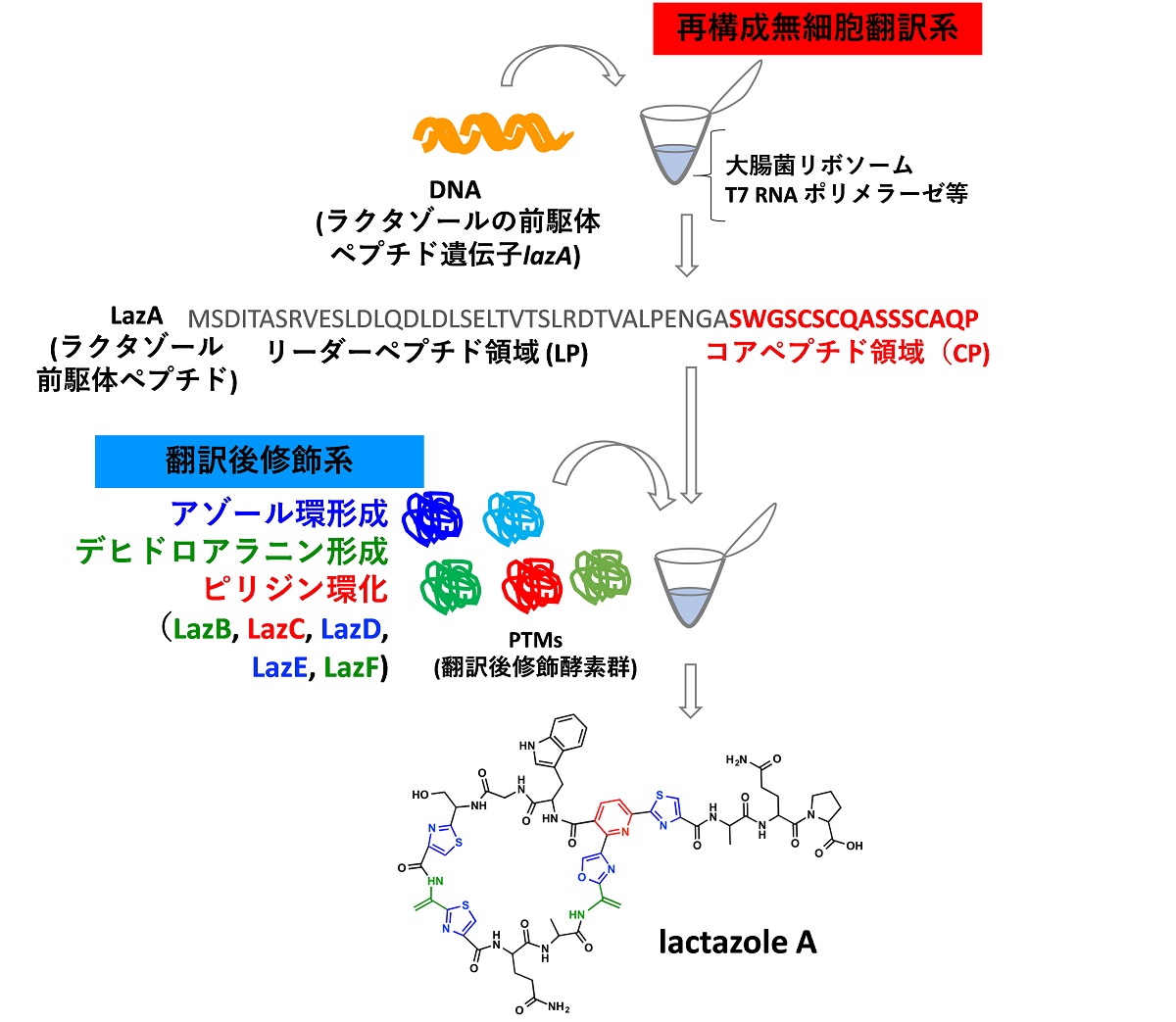
図2 本研究で構築されたFIT-Lazシステムの概要
試験管の中でチオペプチド生合成を再構築する手法の確立。DNA を反応チューブ内に投入するだけでラクタゾールが反応チューブ内で合成されます。
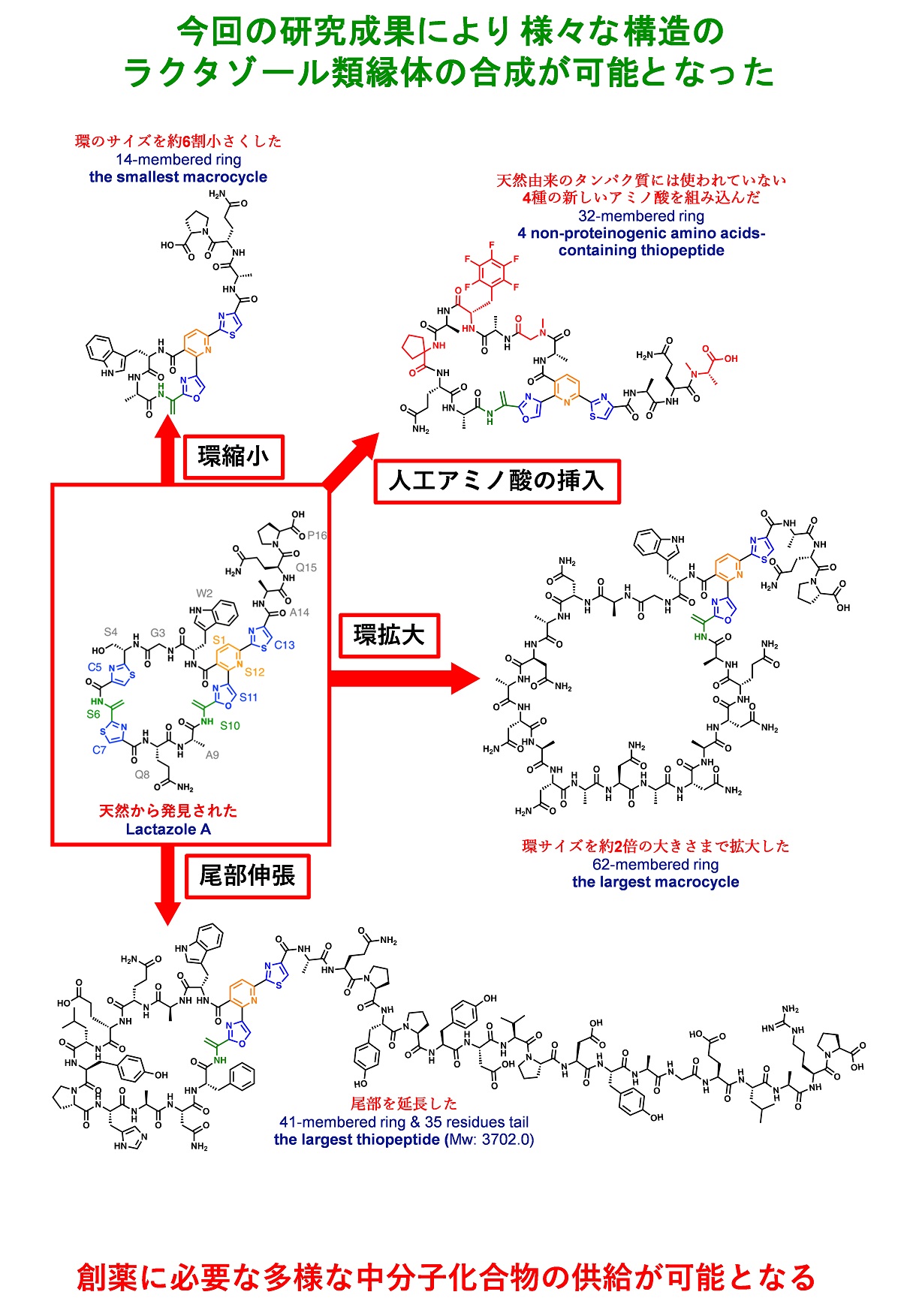
図3 本研究で示された、ラクタゾールを母核としたさまざまな誘導体の創製
自然界に存在する天然物の化学構造多様性を遙かに凌ぐ化学構造が本研究により生み出された。
チオペプチド骨格はピリジン環(注5)を要にしてマクロ環状化しており、複雑な修飾がなされていることから、生体内で安定に特定の分子に特異的に結合することが出来るペプチド系天然物です(図1)。このような性質を有することから、医薬品のリード化合物(注6)として期待される骨格群です。
本研究では、チオペプチドの一種であるラクタゾールの生合成の仕組みを試験管内で完全に再構成することに成功しました。この結果、214 bpの直鎖合成 DNAを投入するだけで24時間以内にラクタゾールの合成を完了することが出来ます(図2)。本システムを用いて、さまざまなラクタゾール誘導体を合成したところ、ラクタゾール生合成酵素群が認識する基質残基は局所的であることが明らかとなり、マクロ環内のアミノ酸の10残基連続置換、環サイズの14員環への縮小、62員環への拡大、尾部アミノ酸の18残基までの延長、4つの非タンパク質性アミノ酸の同時導入などに成功しました(図3)。これらの人工誘導体の構造は、もはやラクタゾールの原形をとどめておらず、ラクタゾール生合成に用いられている酵素群は基質認識において、驚くべき広範な許容範囲を持っていることを証明しました。
ラクタゾールは放線菌Streptomyces lactacystinaeusが生産するチオペプチドです。ラクタゾールは、32個の炭素原子から構成される大きな環状構造を有し、内部にアゾール環(注7)やデヒドロアラニンなどの翻訳後修飾(注8)を受けた構造が存在しており、これらの翻訳後修飾構造が生理活性や化合物の安定化に重要な役目を果たしています(図1)。また、ラクタゾールの合成に関わる遺伝子数は6個であり、一般的なチオペプチド生合成遺伝子群に比べて半数程度とかなり少ない特徴があります(図1)。
チオペプチドは他の抗生物質と比較して、比較的容易に類縁化合物が作製できることに加えて、ラクタゾールは生合成に必要な酵素遺伝子が5個と、他のチオペプチド合成酵素の数より少なく、遺伝子組換え等の遺伝子改変が容易であることから、ラクタゾールを医薬品のリード化合物(注6)にした新たな抗生物質の開発が期待できます。しかしながら、チオペプチド化合物群は有機合成が難しく、効率的な生産方法がありませんでした。
本研究では、再構成無細胞翻訳系(注9)と翻訳後修飾酵素を組み合わせることで、人工的に合成したlazA遺伝子の転写・翻訳から翻訳後修飾反応までの全ての工程を、試験管内で連続的に行い、ラクタゾールを合成することに成功しました(図2)。このように遺伝子の転写翻訳から翻訳後修飾に至るまでの全ての工程を試験管内で再構成したチオペプチドの生合成系は世界初です。
本手法では、わずか200塩基対程度の人工合成が容易な長さのDNAさえ用意すれば、ラクタゾールやその類縁体化合物を簡便かつ迅速に合成することが可能です。再構成無細胞翻訳合成系は既に菅教授によって確立されたFIT systemを採用し、そこに大腸菌組換えタンパク質として調製しておいた6個の翻訳後修飾酵素・LazB, LazC, LazD, LazE, LazF, GluRSを添加することにより、DNA遺伝子からタンパク質への転写翻訳と翻訳後修飾を連続的に反応させるFIT-Lazシステムを構築しました。FIT-Lazシステム反応チューブ内に、人工合成した214 bpのlazA遺伝子を添加するだけで、反応液中でタンパク質合成とそれに続く翻訳後修飾反応が連続して起こり、1日でラクタゾールが合成されます。この利点を活かして、全部で102種類のlazA変異遺伝子をデザインし、そのうち92種類のラクタゾール類縁体の合成が確認できました。
今回新たに合成された92種類の新規ラクタゾール類縁体の化学構造はバラエティーに富んでおり、大きな環状構造内のアミノ酸を10残基連続で置換した類縁体、ラクタゾールの大きな環状構造サイズは32員環ですが、この環状構造サイズを14員環へと縮小した類縁体、反対に62員環へ拡大した類縁体、大きな環状構造の外側に位置する4残基からなる尾部アミノ酸残基を18残基まで伸ばした類縁体、4つの非タンパク質性アミノ酸(注4)を同時導入した類縁体などの合成に成功しました。これらの構造上の特徴はこれまでに報告されている100種類余りある天然チオペプチドには見られない構造であり、自然界で生み出された天然物の化学構造の多様性を遙かに超えた化学構造を有しています。
このように天然に見出されるチオペプチド構造を遙かに超えた多様なラクタゾール類縁体を試験管内で短時間に創製することが可能となりました。本成果で生産可能となった人工チオペプチド誘導体から、今後医薬品の候補化合物が生み出されることが期待されます。
なお、本研究を行った東京大学大学院農学生命科学研究科微生物潜在酵素寄付講座は、天野エンザイム株式会社の寄付によって設立された寄付講座です。
発表雑誌
- 雑誌名
- 「Nature Communications」(5月8日オンライン版)
- 論文タイトル
- Minimal lactazole scaffold for in vitro thiopeptide bioengineering
- 著者
- Alexander A. Vinogradov, Morito Shimomura, Yuki Goto, Taro Ozaki, Shumpei Asamizu, Yoshinori Sugai, Hiroaki Suga, and Hiroyasu Onaka
- DOI番号
- 10.1038/s41467-020-16145-4
- 論文URL
- http://www.nature.com/ncomms
問い合わせ先
東京大学大学院農学生命科学研究科 微生物潜在酵素(天野エンザイム)寄付講座
特任教授 尾仲 宏康(おなか ひろやす)
Tel:03-5841-1602
Fax:03-5841-1608
E-mail:aonaka<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
HP:http://microbial-potential.bt.a.u-tokyo.ac.jp/
用語解説
- 注1 チオペプチド化合物群
チオペプチドはペプチド化合物の一種ですが、構造内にピリジン環(注5)を要とする大員環構造を有し、アゾール環(注7)やデヒドロアラニンなどの通常のアミノ酸構造とは違う構造を有する細菌が生産する天然物の一群です。これまでに100種類以上が微生物から発見されています。多くのチオペプチドには抗菌活性があり、院内感染で問題となっている抗生物質の効かない微生物(MRSAやVRE等)に対しても抗菌活性を示すものも報告されており、今後、医薬品として開発されることが期待されている化合物群です。また、チオペプチドのペプチド骨格構造は、生物に普遍的に存在する蛋白質(ポリペプチド)合成装置であるリボソームにより合成されることから、骨格構造遺伝子の塩基置換により、容易に類縁体を作り出せる利点があります。 - 注2 天然物に頼る現状では種類の限界があります
これまで人類は微生物、植物等さまざまな生物から医薬品の原料となる天然物の探索を行なってきました。その結果、近年では、新規構造の天然物の発見数が減少しており、主要な天然物は既に取り尽くされたともいわれています。現在では稀少な天然物を発見するために、特殊な環境に生息する稀少な微生物の探索やゲノム情報を活用した効率的な探索法も試験管内に行われていますが、必ずしも新規天然物を効果的に発見できているわけではないのが現状です。 - 注3 放線菌
放射状に菌糸を生やして生育する真性細菌の一群で多様な種を有します。主に土壌中に広く生息し、環境中では有機物の分解者としての役目を果たしています。産業的には抗生物質をはじめ、医薬品の原料となる多様な二次代謝産物を作る菌として知られており、結核の特効薬ストレプトマイシンや抗生物質エリスロマイシン、免疫抑制剤タクロリムス、抗寄生虫薬エバーメクチンなどを生産します。 - 注4 非タンパク質性アミノ酸
生体内でのタンパク質合成には20種類のアミノ酸が用いられますが、非タンパク質性アミノ酸はこれら20種類以外のアミノ酸のことを総称します。非タンパク質性アミノ酸が含有したタンパク質やペプチドは天然には存在しないため、新たな生物活性が生じることが期待できます。 - 注5 ピリジン環
炭素原子5個と窒素原子1個で骨格を構成する6員環。チオペプチドではピリジン環の部分でペプチド鎖が結合しており、大員環形成の要となっています。また、ピリジン環にアゾール環が連結した構造はチオペプチドが抗菌活性を生じるために重要な構造と考えられています。 - 注6 医薬品のリード化合物
医薬品を開発する際に基になる化合物のことをリード化合物といいます。ある疾病に対する医薬品の開発において、最初に疾病に対して薬効のある化合物を天然物や化学合成品の中から探索します。この大本となる化合物のことをリード化合物といいます。創薬開発においてはいかに活性の高いリード化合物を見出せるかが重要です。 - 注7 アゾール環
窒素原子1個を含む5員環。ラクタゾールにおいては窒素原子1個、酸素原子1個、炭素原子3個からなるオキサゾール環と窒素原子1個、硫黄原子1個、炭素原子3個からなるチアゾール環の二種類のアゾール環が存在しています。これらの構造はセリン、システインなどが修飾を受けることにより生成します。アゾール環は生理活性を生じさせるための重要な構造です。 - 注8 翻訳後修飾
生体内ではDNA遺伝子からタンパク質やペプチドが作られる過程を翻訳と呼びますが、一部のタンパク質やペプチドには翻訳合成された後に修飾反応を受けるものがあります。これらの修飾反応全般を翻訳後修飾と呼びます。翻訳後修飾にはさまざまな酵素反応が知られていますが、チオペプチド化合物においての翻訳後修飾の主なものはピリジン化(注5)、アゾール環化(注6)、デヒドロアラニン化です。翻訳後修飾を受けることにより、プロテアーゼからの分解を受けづらくなることから生体内で安定化することが知られています。また、しばしば翻訳後修飾構造が生理活性に重要な構造となっています。 - 注9 再構成無細胞翻訳系
DNA遺伝子からタンパク質への転写翻訳は通常、生体細胞内でRNAポリメラーゼによるDNAからmRNAへの転写反応とリボソームによるmRNAからタンパク質やペプチド分子への翻訳反応の二つからなります。これら二つの反応に必要な酵素を全て組換えタンパク質として調製して原料基質と混合した溶液によって、転写翻訳反応を細胞を用いずに無生物的に再構成することを再構成無細胞翻訳系といいます。

