II型ポリケチド合成酵素複合体の全体構造を世界に先駆けて解明
- 発表者
- ト タンヤオ (東京大学大学院農学生命科学研究科・応用生命工学専攻 博士課程3年:当時、2018年度研究科長賞受賞)
勝山 陽平 (東京大学大学院農学生命科学研究科・応用生命工学専攻 准教授)
堀内 真展 (東京大学大学院農学生命科学研究科・応用生命工学専攻 修士課程2年)
伏信 進矢 (東京大学大学院農学生命科学研究科・応用生命工学専攻 教授)
Aochiu Chen (Department of Chemistry and Biochemistry, University of California, San Diego, Master course student)
Tony D. Davis (Department of Chemistry and Biochemistry, University of California, San Diego, Researcher)
Michael D. Burkart (Department of Chemistry and Biochemistry, University of California, San Diego, Professor)
大西 康夫 (東京大学大学院農学生命科学研究科・応用生命工学専攻 教授)
発表のポイント
- II型ポリケチド合成酵素のサブユニットである、ケト合成酵素、鎖長決定因子、アシルキャリアータンパク質複合体の立体構造を世界で初めて報告しました。
- ケト合成酵素と鎖長決定因子の複合体がどのように自身専用のアシルキャリアータンパク質を認識しているか明らかにしました。
- ポリエンを合成するという珍しいタイプのII型ポリケチド合成酵素において、ポリエンを選択的に合成する分子機構の一部を明らかにしました。
発表概要
東京大学大学院農学生命科学研究科・応用生命工学専攻のグループは、放線菌 (注1) の生産するポリケチド (注2) であるイシガミドの生合成経路よりポリエン (注3) を生合成する高還元型II型ポリケチド合成酵素 (polyketide synthase, PKS) を見出し1、その反応の試験管内再構築に成功していました2。今回、同グループはカリフォルニア大学サンディエゴ校のグループとの共同研究によりイシガミドの生合成を担うPKS (IgaPKS) の中でも特に重要なケト合成酵素 (ketosynthase, KS) と鎖長決定因子 (chain length factor, CLF)の複合体 (KS–CLF; Iga11–Iga12) の構造をX線結晶構造解析 (注4) により明らかにしました。さらに、イシガミド生合成中間体の運搬を担うアシルキャリアータンパク質 (acyl carrier protein, ACP; Iga10) とKS–CLFの三者複合体の構造を明らかにしました。この構造と部位特異的変異導入 (注5) 実験の結果から、KS–CLFとACPの相互作用機構は類縁酵素である脂肪酸合成酵素 (fatty acid synthase, FAS) におけるKS二量体とACP間の相互作用機構と異なることがわかりました。この結果により、進化的に同じ起源をもつFASとPKSがそれぞれに対応するACPを見分けるための分子機構の一部が明らかになりました。また、IgaPKSは共役テトラエン (注6) を持つ炭素数14のカルボン酸を合成しますが、KS–CLFにより構成される反応ポケットの大きさが最終産物の炭素数に、反応ポケット中央付近に位置するアスパラギン酸残基の電荷がポリエンの合成にそれぞれ重要であることがわかりました。
参考文献
- D. Du, Y. Katsuyama, H. Onaka, M. Fujie, N. Satoh, K. Shin-Ya, Y. Ohnishi. Production of a Novel Amide-Containing Polyene by Activating a Cryptic Biosynthetic Gene Cluster in Streptomyces sp. MSC090213JE08. Chembiochem 17: 1464–1471, 2016.
- D. Du, Y. Katsuyama, K. Shin-Ya, Y. Ohnishi. Reconstitution of a Type II Polyketide Synthase that Catalyzes Polyene Formation. Angew. Chem. Int. Ed. Engl. 57: 1954-1957, 2018.
発表内容
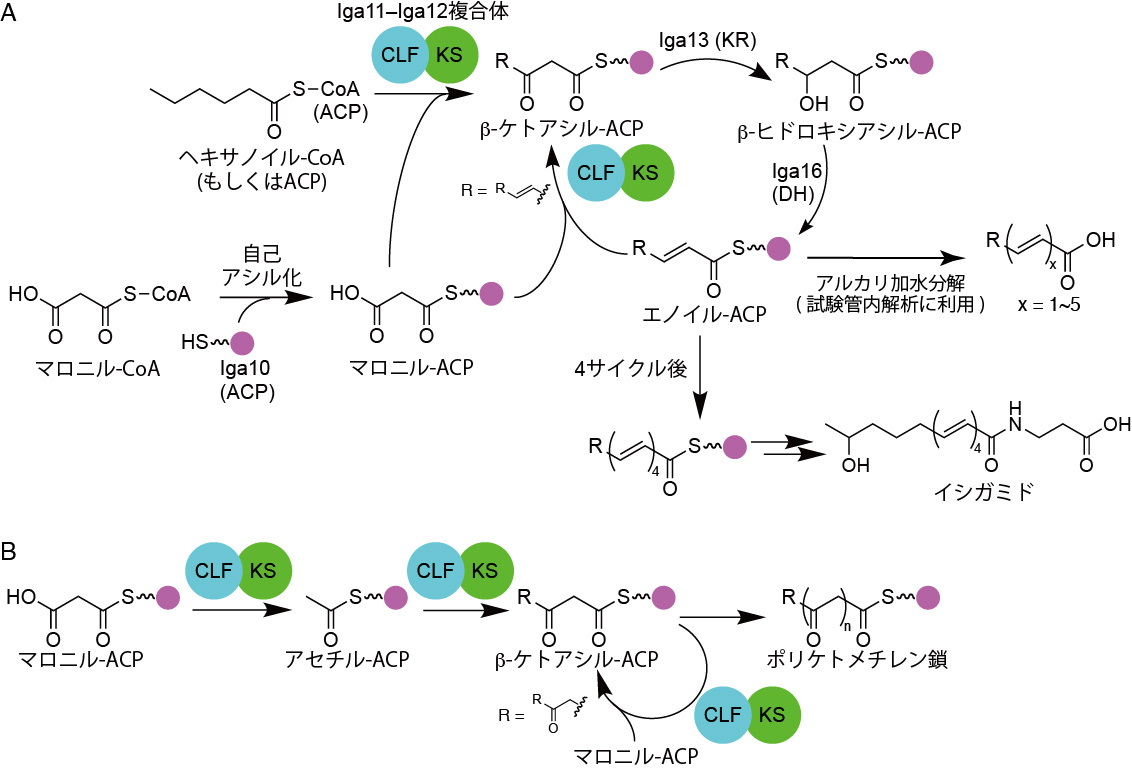
図1 イシガミドの生合成経路 (A) と通常のII型PKSが触媒する反応 (B)。
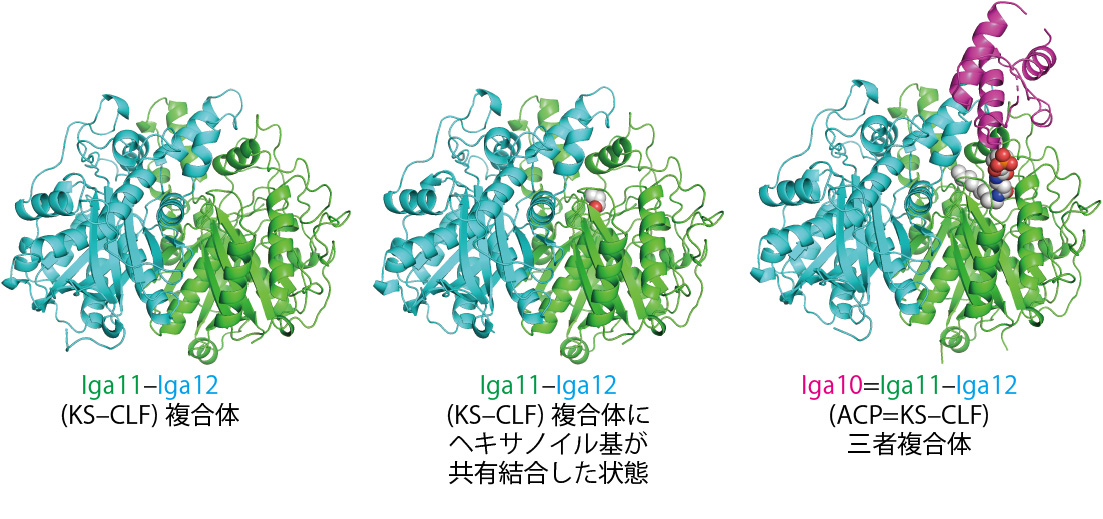
図2 Iga11–Iga12複合体の構造とIga10=Iga11–Iga12、三者複合体の構造
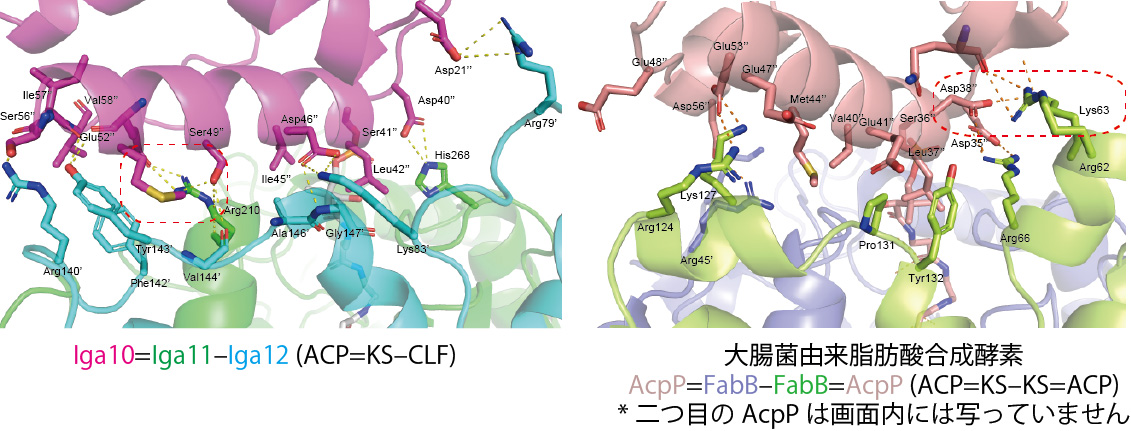
図3 Iga11–Iga12とIga10間 (左)および FabBホモ二量体とAcpP間 (右) の相互作用面。
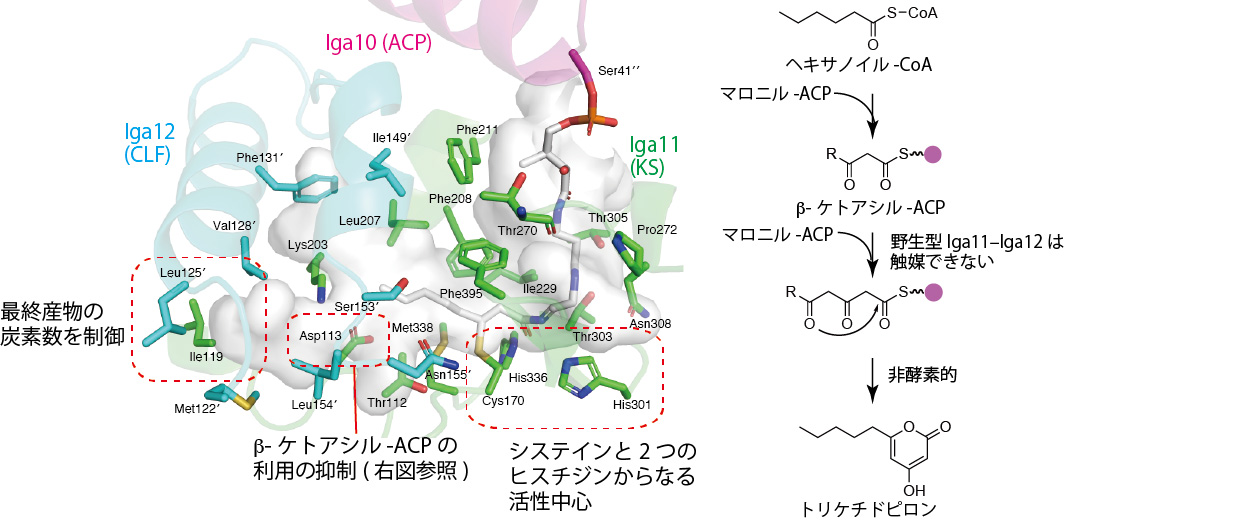
図4 Iga11–Iga12内にあるポケットの構造 (左) とトリケチドピロンの生成機構 (右)。
ポリケチドは植物、微生物など様々な生物が生産する生理活性物質の一群です。抗生物質であるテトラサイクリンや抗がん剤であるドキソルビシンのように有用な生理活性を持つものも多く、重要な医薬品資源となってきました。ポリケチドはポリケチド合成酵素 (polyketide synthase, PKS) が酢酸ユニットを連結していくことで生合成されます。PKSはその構造から3種に分類されます。I型PKSは異なる機能をもつ酵素が複数融合した巨大なタンパク質であり、II型PKSは単独の機能を持つ複数の酵素の集まりです。また、III型PKSはケト合成酵素 (ketosynthase, KS) のホモ二量体のみからなる特殊なPKSです。
II型PKSにおいて特に重要な機能を担う酵素はKS–鎖長決定因子 (chain length factor, CLF) のヘテロ二量体です。また、基質や中間体の運搬を担うアシルキャリアータンパク質 (acyl carrier protein, ACP) も必須であることがわかっています。KS–CLFヘテロ二量体はアシル-ACPとマロニル-ACPの間で脱炭酸を伴うクライゼン縮合 (注7) を触媒することで、ポリケチド鎖の伸長反応を触媒します。この伸長反応が複数回繰り返されることで、ケトンを多数持つ、ポリケトメチレン鎖が合成されます。ポリケトメチレン鎖はさらに様々な修飾反応を受けることで最終産物である芳香族ポリケチドへと変換されていきます (図1B)。
最近、私たちのグループはイシガミドと名付けた化合物の生合成経路を解析することでポリエンを合成する「高還元型II型PKS」の一つであるIgaPKSの同定に成功しました (図1A)。これまでに機能解析されてきたII型PKSの大半は還元度の低い芳香族ポリケチドの生合成を担うため、炭素伸長を行うクライゼン縮合反応がKS–CLFヘテロ二量体の中で、連続して起こります (図1B)。しかし、高還元型II型PKSではクライゼン縮合により合成されたβ-ケトアシル-ACPが酵素外に放出され、ケト還元酵素 (ketoreductase, KR; Iga13) による還元と脱水酵素 (dehydratase, DH; Iga16) による脱水を受け、エノイル-ACPへと変換される必要があります。また、ACPに目を向けるとイシガミド生産菌の細胞内には、IgaPKSのACPだけではなく、オキセノンという芳香族化合物を合成するII型PKSおよび脂肪酸合成酵素 (fatty acid synthase, FAS) にそれぞれ用いられるACPも存在します。このように3種のACPが存在するため、正しくイシガミドを作るためにはイシガミド生合成に関わる酵素 (Iga11–Iga12, Iga13, Iga16) は自身のパートナーとなるACP (Iga10) を他のACPから見分けて用いる必要があります。そこで、高還元型II型PKSのKS–CLFであるIga11–Iga12が、どのようにしてβ-ケトアシル-ACPを酵素外に放出しているのか、また、どのようにして自身のパートナーとなるACPを見分けているかを明らかにすべく、X線結晶構造解析に取り組みました。
まず、フリーのIga11–Iga12の構造、さらにヘキサノイル基が活性中心 (注8) であるシステインに共有結合したIga11–Iga12の構造をX線結晶構造解析により明らかにしました(図2)。その結果、Iga11–Iga12ヘテロ二量体はヘキサノイル基の結合に応じた構造変化をほとんど示さなかったことから、比較的硬い構造をしていることがわかりました。また、Iga11–Iga12複合体の全体構造は過去に報告されたII型PKSであるActKS–CLF (アクチノロージン生合成を担う) と類似した全体構造を取っていました。
次に、Iga11–Iga12とIga10 (ACP) の三者複合体の構造解析を試みました。通常、KS–CLFとACPの相互作用はそれほど強くないため、これらを混ぜ合わせるだけでは三者複合体の結晶の取得は困難と予想されました。そこで、三者複合体の取得にはカリフォルニア大学サンディエゴ校のBurkart教授らによって開発された、反応機構利用型架橋剤を利用することにしました。架橋剤とはタンパク質同士を共有結合により架橋することでタンパク質複合体を安定に保持させるために用いられる試薬です。しかし、通常の架橋剤はランダムに反応を行うため、架橋の効率が低い場合もあります。反応機構利用型架橋剤は酵素の反応機構を利用し、酵素自身が架橋形成を促進するように設計された架橋剤です。そのため、より効率的に目的の三者複合体の取得ができると考えられます。この反応機構利用型架橋剤を利用して調製したIga10=Iga11–Iga12 (ここで「=」は共有結合を表します) を用いてX線結晶構造解析を行った結果、Iga10=Iga11–Iga12三者複合体の構造を明らかにすることに成功しました(図2-4)。
まず、Iga10とIga11–Iga12の相互作用面を大腸菌由来FASのAcpP (ACP)とFabB (KS)の相互作用面と比較しました (図3)。(AcpPとFabB複合体の構造は昨年報告されたばかりのものです。)その結果、いずれの複合体においても、ACPの2つ目のαヘリックスが相互作用に重要な点は共通していました。しかしながら、結合の位置が異なるため、相互作用に重要なアミノ酸残基の位置はずれていました。部位特異的変異導入実験の結果、Iga10とIga11–Iga12の相互作用にはIga11の210番目のアルギニン残基が特に重要であることがわかりました。FabBとAcpPの相互作用ではFabBの62番目、63番目の2つのアルギニン残基とACPの38番目のアスパラギン酸残基が重要であることが示されていますが、この位置に対応するアミノ酸はIga11–Iga12とIga10の相互作用にはあまり寄与していませんでした。このことから、KS (–CLF) とACPの相互作用を理解するためにはまず、ACPのαヘリックスの結合位置が重要であることがわかりました。
次に、Iga11–Iga12から作られるポケットに着目しました (図4)。Iga10が運んできた基質を挿入するための入り口はIga11の表面にあります。その入り口の真下にシステインと2つのヒスチジンからなる活性中心が位置しており、さらに図中左側 (Iga12の方向) に基質収納ポケットが伸びています。基質収納ポケットの末端の壁はIga12により作られており、そこには125番目のロイシンが位置しています。Iga11–Iga12は通常炭素数14の共役テトラエン(注6、図1A 右端のx = 4の化合物)までしか作ることができません。しかし、この125番目のロイシンをより小さいアラニンに置換したところ、Iga11–Iga12は炭素数16の共役ペンタエン (注6、図1A 右端のx = 5の化合物) を生産する能力を獲得しました。このことからIga12が最終産物の炭素数を制御する役割をもつことが確かに示されました。
さらに、基質収納ポケットの中央に着目しました。ActKS–CLFと比較したところ、Iga11–Iga12では基質収納ポケットの中央に親水性アミノ酸が多いことがわかりました。野生型のIga11–Iga12はβ-ケトアシルACPを基質に用いてクライゼン縮合を触媒することができません。しかし、これらの親水性アミノ酸のうち、Iga11の113番目のアスパラギン酸をアラニンに置換したところ、Iga11–Iga12はβ-ケトアシル-ACPを基質としてクライゼン縮合を触媒する能力を獲得し、トリケチドピロン (注9) を生産することがわかりました。このことから、113番目のアスパラギン酸残基の負電荷がβ-ケトアシル-ACPの排出に重要な役割を持つことがわかりました。
以上、本研究によって、高還元型II型PKSにおけるACP=KS–CLF三者複合体(Iga10=Iga11–Iga12)の構造が世界で初めて明らかになりました。その結果、Iga11–Iga12とACPの結合様式が解明され、昨年報告された脂肪酸合成酵素とACPの結合様式との比較によって、類似のシステムであるII型PKSと脂肪酸合成酵素がそれぞれのACPを見分ける機構の一端が明らかになりました。さらに、高還元型II型PKSと通常のII型PKSの最終産物の違いには、高還元型II型PKSの基質収納ポケット中のアスパラギン酸残基の負電荷とβ-ケトアシル基の反発が重要であることがわかりました。さらに、高還元型II型PKSにおいても、CLFが最終産物の炭素数を制御していることがわかりました。これらの成果はPKSの反応機構を理解する上で極めて重要であり、今後、PKSを人工的にデザインするための基盤情報を提供することになります。
発表雑誌
- 雑誌名
- Nature Chemical Biology (2020年5月4日オンライン公開, ロンドン時間)
- 論文タイトル
- Structural basis for selectivity in a highly reducing type II polyketide synthase
- 著者
- Danyao Du, Yohei Katsuyama, Masanobu Horiuchi, Shinya Fushinobu, Aochiu Chen, Tony D. Davis, Michael D. Burkart, Yasuo Ohnishi.
- DOI番号
- 10.1038/s41589-020-0530-0
- 論文URL
- https://www.nature.com/articles/s41589-020-0530-0
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 醗酵学研究室
准教授 勝山 陽平(かつやま ようへい)
Tel:03-5841-5124
Faxl:03-5841-8021
研究室URL:http://park.itc.u-tokyo.ac.jp/hakko/
用語解説
- 注1 放線菌
真正細菌の一群で、菌糸を放射状に伸長させて増殖することから名付けられた。このような形態学的な特徴に加え、多くの二次代謝産物を作り出す能力を持つことでも知られ、クスリを作る微生物として産業上、有用である。放線菌が生産するさまざまな抗生物質は、医療現場で欠かせないものになっている。 - 注2 ポリケチド
酢酸ユニットを基本単位とした多様な構造を示す化合物の総称。植物や微生物などの二次代謝産物として生合成されており、多様な生理活性を示すため、医薬品資源として重要である。 - 注3 ポリエン
少なくとも3つの二重結合と単結合が交互に並んだ炭化水素鎖構造をもつ化合物の総称。 - 注4 X線結晶構造解析
タンパク質の結晶にX線を照射し、得られた回折像を解析することで、タンパク質の立体構造を明らかにする方法。 - 注5 部位特異的変異導入
遺伝子の狙った場所に変異を導入する方法。本研究では1アミノ酸置換を生じる変異を導入し、改変酵素の活性を調べることで、そのアミノ酸の機能を推定するために用いている。 - 注6 共役テトラエン、共役ペンタエン
4つの二重結合が並んだ状態のポリエンを共役テトラエン、5つ並んだ場合を共役ペンタエンと呼ぶ。 - 注7 クライゼン縮合
エステルに対してもう一分子のエステルが縮合することで新しい炭素-炭素結合形成すると同時に炭素-酸素結合の切断が起こり、β-ケトエステルが生成する反応。 - 注8 活性中心
酵素中で基質が結合し反応の進行を促進させる部位。 - 注9 トリケチドピロン
PKSが縮合反応を一回触媒した結果できる化合物をジケチド、二回触媒した結果できる化合物をトリケチドと呼ぶ。PKSにより直接作られるトリケチドは不安定であり、自発的に環状化し、トリケチドピロンへと変換される。

