蛋白質レベルの収斂進化によって微生物は結晶性セルロースを壊せるようになった
- 発表者
- 内山 拓(東京大学大学院農学生命科学研究科 農学特定研究員(研究当時、現バイオインダストリー協会先端技術・開発部つくば研究室 室長))
内橋 貴之(名古屋大学大学院理学研究科 教授・自然科学研究機構生命創成探究センター 客員教授)
中村 彰彦(静岡大学農学部応用生命科学科 准教授)
渡辺 大輝(自然科学研究機構生命創成探究センター 特任助教(研究当時))
金子 哲(琉球大学農学部亜熱帯生物資源科学科 教授)
鮫島 正浩(東京大学大学院農学生命科学研究科 教授(研究当時、現信州大学特任教授))
五十嵐 圭日子(東京大学大学院農学生命科学研究科 生物材料科学専攻 准教授・VTTフィンランド技術研究センター 客員教授)
発表のポイント
- 固体であるセルロース分解に適したバクテリア由来のセルラーゼ2種が、大工道具の「鉋(かんな)」のようにセルロース表面上から外れる事なくセルロース分解を行う様子を、高速原子間力顕微鏡を用いて観察しました。
- カビ由来の鉋型セルラーゼ(プロセッシブセルラーゼ)とバクテリア由来のセルラーゼでは、元になる蛋白質の骨格は全く異なりますが、「基質結合部を非対称にする」と「基質を覆うループを増やす」という共通の戦略で、同じような機能を持つ酵素を作り出していることが明らかとなりました。
- 本研究成果は、自然界が蛋白質レベルの収斂進化(注1)によって、セルロースを効率よく分解する酵素を獲得してきたことを示しており、セルロース系バイオマス利用の効率化に貢献する事が期待されるとともに、骨格が異なる蛋白質に新しい機能を付与できる可能性を示しています。
発表概要
植物の体を形作っているセルロースを分解するための酵素「セルラーゼ」に関する研究成果について論文発表を行いました。本研究チームは、これまでも高速原子間力顕微鏡という特殊な顕微鏡を用いて、結晶性セルロースを分解するために最適化されたきのこやカビなどの糸状菌が生産するプロセッシブセルラーゼを、分子レベルで観察することに成功していますが、内山拓農学特定研究員と五十嵐圭日子准教授らの研究チームは、名古屋大学、分子科学研究所、琉球大学との共同研究で、2種類の細菌(バクテリア)由来のプロセッシブセルラーゼが、カビ・きのこ由来の酵素と同様、結晶性セルロースの表面から外れる事なく鉋がけをするように分解している様子を観察する事に成功しました。今回、分子レベルでの動態観察に成功したバクテリア由来のセルラーゼは、骨格になる蛋白質が糸状菌由来の酵素とは全く異なっていますが、プロセッシブセルラーゼとしての機能を果たすための「基質結合部が活性残基を挟んで非対称である」と「基質を離さないためのループの数が多い」という特徴はきちんと有しており、基質であるセルロース分子鎖を握り締めながら引き込んで活性中心に導き、連続的に分解するような設計となっていることが分かりました。つまり、骨格構造が全く異なっていて結晶性セルロースを分解できない酵素をもとにして、プロセッシブセルラーゼの要素となる部分を付け足すことでその機能を付与する「蛋白質レベルの収斂進化」が起きていること提案しました。本研究成果は、総合学術誌として権威のある米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)に掲載されました。
発表内容
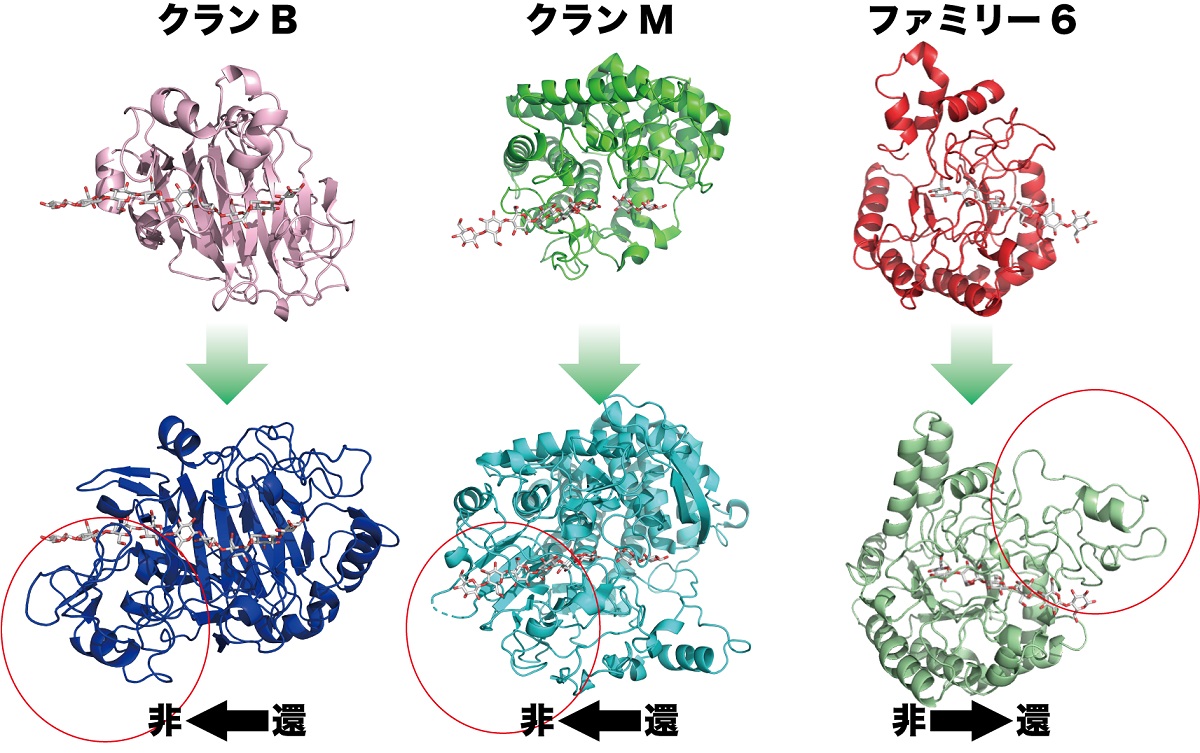
図1 糖質加水分解酵素ファミリー6およびクランB(上段:ファミリー16、下段:ファミリー7)、クランM(上段:ファミリー8、下段:ファミリー48)における、プロセッシブセルラーゼへの進化
上段の酵素は、下段のプロセッシブセルラーゼの元となったと考えられる酵素です。それぞれがプロセッシブセルラーゼとしての機能を獲得するため、分解方向に対して蛋白質を付加して、セルロースを握り締める様な構造を持つように進化したと考えられます。赤丸で囲われた部分は、プロセッシブセルラーゼに特徴的な付加領域を、黒矢印はそれぞれのセルラーゼによるセルロースの分解方向をあらわしています。還:還元末端、非:非還元末端
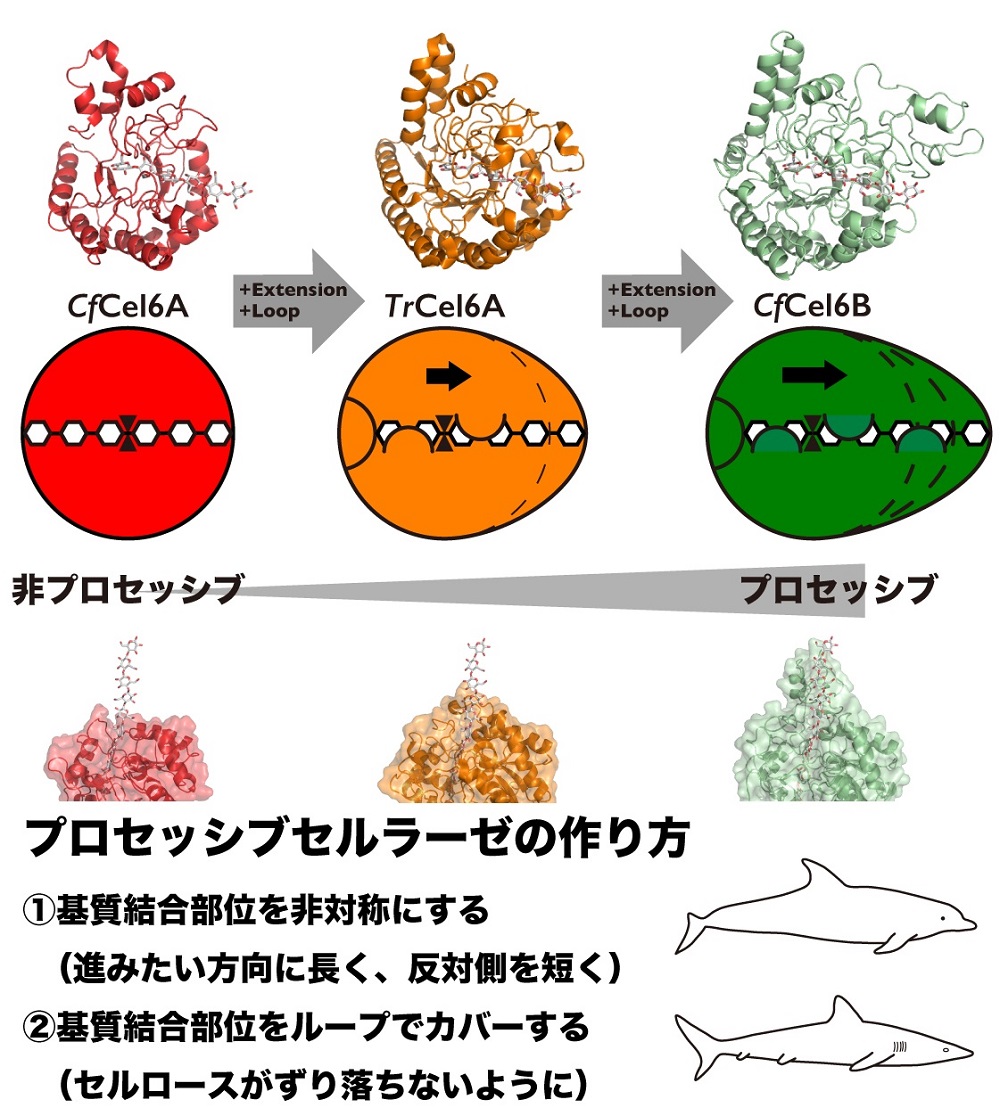
図2 今回提案された自然界におけるプロセッシブセルラーゼの獲得戦略
結晶性セルロースの表面を削りながら進むことができる酵素は、「基質結合部位の非対称性」と「基質を覆うループの数」をどちらも上げる必要がありますが、そのような形をした酵素を獲得したものが、セルロースを効率良く分解できるようになったと考えられます。つまり「タンパク質レベルの収斂進化」が、結晶性セルロースの分解には重要だったと考えられます。
セルロースはブドウ糖(グルコース)が繋がった繊維状ポリマーで、さらに分子鎖が複数束になることで結晶を形成しています。自然界では植物体を構成する構造多糖として存在し、地球上に最も豊富に存在するバイオマスでもあります。一方、天然にはこのセルロースを効率よく分解する「セルラーゼ」という酵素を使って分解・代謝して生きるカビやきのこ、バクテリア等の微生物が存在していて、本酵素はそのままでは栄養にならないセルロースを、生物にとってエネルギーの源であるブドウ糖に変換できる酵素ということで、長い研究の歴史があります。
セルラーゼには様々な種類が存在していますが、中でも結晶性セルロースを効率よく分解することができる酵素は、大工道具の「鉋(かんな)」の様に表面を削り取るように分解を進めるタイプで、「プロセッシブセルラーゼ」と呼ばれています。本研究チームでは長年、高速原子間力顕微鏡(High Speed Atomic Force Microscopy:HS-AFM、注2)を用いる事で、カビやきのこ等の糸状菌由来のファミリー7プロセッシブセルラーゼ(Cel7)がセルロース表面を1方向に動いている様子、すなわちセルロース表面から外れる事なくセルロースを分解している様子を観察することに成功していました(参考文献1-3)。今回はセルロース分解性バクテリアの一種であるCellulomonas fimi由来のプロセッシブセルラーゼであるCfCel6BとCfCel48Aが、セルロース表面上で1方向に動いている様子を観察することに成功しました。
セルロースはグルコースが数千〜数万つながった構造をしていますが、天然に存在する結晶性セルロースは、分子が全て同じ向きで束になっているため、性質の異なる「還元末端」と「非還元末端」が存在します。これまで研究チームは、カビ由来プロセッシブセルラーゼであるTrCel7Aが、還元末端→非還元末端の方向でセルロースを分解することを明らかにして来ましたが、バクテリア由来の酵素のうちCfCel48AはTrCel7Aと同じ方向、すなわち還元末端→非還元末端の方向に、CfCel6Bは逆向きの非還元末端→還元末端方向に分解する様子を、それぞれHS-AFMで観察しました。
実は、カビやきのこ等の糸状菌も今回プロセッシブセルラーゼであることが明らかとなったCfCel6Bと同じ糖質加水分解酵素ファミリー6に属する酵素であるCel6Aを持っていますが、これまでのHS-AFMでの観察ではその分子の動きは観察できませんでした。これは糸状菌由来のCel6Aはプロセッシブ性が低い可能性を示しています。セルラーゼ研究の分野では、ファミリー6に属する酵素が「プロセッシブ」なのか「非プロセッシブ」なのか長年にわたって議論してきましたが、今回の結果から「同じファミリー6の酵素でもプロセッシブと非プロセッシブな酵素が混じっており、その度合いは様々である」という結論が導かれました。
そこで、同じファミリーの酵素がどのようにしてそのような違いを出しているのかそれぞれの酵素の三次元構造から推測したところ、図1に示すようにバクテリア由来の非プロセッシブなセルロースをランダムに切断する酵素(赤色)では、基質結合部が対称な構造で、基質をカバーするループ構造もないのに対して、糸状菌由来の酵素では非対称性とループの数が若干上がり、さらにバクテリア由来のプロセッシブ酵素では極端に非対称になり、ループの数が増えることが分かりました。そのような傾向は全くファミリーが異なるTrCel7AやCfCel48Aでも共通して起こっていると考えられました。つまり、もともと骨格が異なる蛋白質であっても、基質結合部を非対称にして、そこをカバーするようにループを配置することで、非プロセッシブな酵素がプロセッシブな酵素に変化することができ、自然界ではそのような共通の戦略で結晶性セルロースを分解できるようになってきたと考えられたのです。
「収斂進化」とは、哺乳類と魚類というまったく異なる生物種であるイルカとサメが、海の中で早く泳げるように流線形になり、体の同じような場所にヒレを持つようになったように、もともと異なる生物が同じ機能を求めて同じ形に進化してきたことを言います。図2に示すように今回の結果は、ある機能を追求したときにそのような進化が個体レベルではなく蛋白質レベルでも起こっていることを表していると、五十嵐准教授らは考えています。
カビやきのこによるセルロース分解では、プロセッシブなCel7と非プロセッシブなCel6を混ぜることで、結晶性セルロースの分解が劇的に速くなる相乗効果が起こることが知られています。今回、カビ由来のTrCel7Aとバクテリア由来のCfCel6Bを混ぜてHS-AFMによって観察すると、それぞれが逆向きに動いている様子が観察され、時に正面衝突をしてCfCel6Bが吹き飛ぶ様子も観察されました。さらに、事故を起こして止まったTrCel7A分子の後方に次々と他の分子がぶつかり、事故渋滞が生じる様子も観察されました。しかしながら、同じカビ由来の2種類の酵素(Cel6とCel7)を混ぜた場合は、このようなナノレベルの交通事故と事故渋滞は起こりませんでした。つまり、分解方向が逆向きのプロセッシブな酵素同士はあまり相性がよくないことを示しており、糸状菌ではあえて一方(Cel6)はプロセッシブな酵素を使わない戦略をとっている可能性が考えられました。しかしながら、バクテリアが還元末端→非還元末端と非還元末端→還元末端の双方向のプロセッシブセルラーゼを持っていることを考えると、実は糸状菌はまだ進化の途中で、これからより分解性の高い酵素系を獲得していく可能性も残されています。このように、進化的視点でセルロース分解を捉えていくことで、研究チームはより効率の良いバイオマス変換系の構築を目指して行こうと考えています。
本研究の一部は、文部科学省科学研究費補助金新学術領域研究「植物の力学的最適化戦略に基づくサステナブル構造システムの基盤創成」(領域代表:奈良先端科学技術大学 出村拓 教授、計画研究代表者:五十嵐圭日子)およびBusiness Finlandフィンランド卓越教授(FiDiPro)プログラム「Advanced approaches for enzymatic biomass utilization and modification(BioAd)」(五十嵐圭日子)の補助を受けたものです。
発表雑誌
- 雑誌名
- Proceedings of the National Academy of Sciences of the United States of America(8月3日 オンライン公開)
- 論文タイトル
- Convergent evolution of processivity in bacterial and fungal cellulases
- 著者
- Taku Uchiyama†, Takayuki Uchihashi†, Akihiko Nakamura, Hiroki Watanabe, Satoshi Kaneko, Masahiro Samejima, and Kiyohiko Igarashi*(†共同筆頭著者、*責任著者)
- DOI番号
- 10.1073/pnas.2011366117
- 論文URL
- https://www.pnas.org/content/early/2020/07/29/2011366117
問い合わせ先
東京大学 大学院農学生命科学研究科 生物材料科学専攻
准教授 五十嵐 圭日子(いがらし きよひこ)
Tel:03-5841-5258
E-mail:aquarius<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
参考文献
- 1. Igarashi, K., Koivula, A., Wada, M., Kimura, S., Penttilä, M., and Samejima, M., High-speed atomic force microscopy visualizes processive movement of Trichoderma reesei cellobiohydrolase I on crystalline cellulose, J. Biol. Chem. 284:36186-36190 (2009)
- 2. Igarashi, K., Uchihashi, T., Koivula, A., Wada, M., Kimura, S., Okamoto, T., Penttilä, M., Ando, T., and Samejima, M., Traffic jams reduce hydrolytic efficiency of cellulase on cellulose surface, Science 333: 1279-1282 (2011)
- 3. Nakamura, A., Watanabe, H., Ishida, T., Uchihashi, T., Wada, M., Ando, T., Igarashi, K., and Samejima, M., Trade-off between processivity and hydrolytic velocity of cellobiohydrolases at the surface of crystalline cellulose, J. Amer. Chem. Soc. 136: 4584–4592 (2014)
用語解説
- 注1 収斂進化
異なる生物種に属する生物が、進化の過程で同じような環境で同じような形質を独立に獲得する現象。例えばサメとイルカは、それぞれ魚類と哺乳類という全く異なる生物種であるにもかかわらず同じような形態を有しているのは、流線型でかつ鰭(ひれ)を適切に配置した形態が、どちらの進化においても生存に有利だったためと考えられています。 - 注2 高速原子間力顕微鏡
原子間力顕微鏡(Atomic Force Microscopy:AFM)は、探針(プローブ)を観察対象の表面に沿って走査することで観察対象の形の情報(画像)を得ます。しかしながら従来の原子間力顕微鏡は1画像取得するのに数分を要していたため、対象物の変化をリアルタイムで追うことは困難でした。研究チームは、走査速度を通常のAFMと比較して格段に早くした高速原子間力顕微鏡を用いて、固体表面を動くセルラーゼ分子を世界ではじめて可視化しました。

