コロナウイルス感染症における細胞傷害性T細胞およびインターフェロン-γの役割:マウスのコロナウイルス感染症からの教訓
- 発表者
- 久和 茂(東京大学大学院農学生命科学研究科獣医学専攻 教授)
杉浦由季(東京大学大学院農学生命科学研究科獣医学専攻 博士課程)
発表のポイント
- 発表者らのこれまでの研究成果を中心に、コロナウイルス感染症における細胞傷害性T細胞(CTL)およびインターフェロン-γ(IFN-γ)の役割をまとめ、発表しました。
- コロナウイルス感染症においてもCTLやIFN-γが重要な生体防御機構であることをマウスコロナウイルス感染症の実験データをもとに合理的に説明しました。
- これらの情報は、新型コロナウイルス感染症(COVID-19)などの他のコロナウイルス感染症への応用が期待されます。
発表概要
東京大学大学院農学生命科学研究科の久和教授らはマウスコロナウイルスを用いて、①コロナウイルス感染症において細胞傷害性T細胞(CTL)(注1)およびインターフェロン-γ(IFN-γ)(注2)が生体からのウイルス排除において重要な役割を果たしていること明らかにし、②免疫不全状態においてはウイルスゲノムが変異したCTL抵抗性コロナウイルスが出現すること、さらに、③変異したCTL抵抗性コロナウイルスは、特定のマウスにおいて高病原性を示すことなどを発表しています。これらの研究成果を中心にコロナウイルス感染症におけるCTLとIFN-γの役割をまとめ、発表しました。
コロナウイルス感染症におけるウイルス排除における細胞性免疫の役割にフォーカスした総説はほとんどなく、実験データを基にCTLやIFN-γの重要性を合理的に解説した本論文は貴重であると考えられます。
マウスモデルから得られているCTLやIFN-γに関する情報は、新型コロナウイルス感染症(COVID-19)などの他のコロナウイルス感染症の病態の理解、さらには治療法(薬剤などを含む)および予防法(ワクチンなどを含む)の開発において有用なヒントとなることが期待されます。
発表内容
【研究の背景】
コロナウイルスはニドウイルス目に属する一本鎖プラス鎖RNAをゲノムとして持つエンベロープウイルスで、αコロナウイルス、βコロナウイルス、γコロナウイルス、およびδコロナウイルスの4つの属に分類されています。コロナウイルスは突然変異、遺伝子組換え、さらに遺伝子の獲得あるいは欠失を経て進化しており、非常に多様性に富むウイルス群です。コロナウイルスを原因とする動物の病気は多く、獣医学領域ではきわめて重要なウイルスです。一方、ヒトに感染するヒトコロナウイルスは重篤な疾患を引き起こさなかったため(風邪の原因の一部)、医学においてはあまり重要視されてきませんでした。しかし例外があり、2002-2004年に発生した重症急性呼吸器症候群(SARS)や、今も散発的な発生がみられる中東呼吸器症候群(MERS)はコロナウイルスによるヒトの重篤な疾患です。そのような状況の中、2019年末に中国・武漢市において原因不明の肺炎患者が多発し、解析の結果、新型のβコロナウイルス(SARS-CoV-2)が原因であることが分かりました。その後、新型コロナウイルス感染症(COVID-19)は世界中に拡大し、現在も各地で未曽有のパニックを引き起こしています。 COVID-19に対する有効な治療法は未だ確立されておらず、ワクチンもありません。また、感染によって起こる症状の幅が非常に大きく、無症状で経過する人もいる一方で、重症化し死に至るケースもあります。高齢者や基礎疾患を持つ人が重症化しやすい、また重症化にはヒトの免疫機構の暴走が関与しているのではないかと言われていますが、詳細は不明です。 マウスコロナウイルスはマウスに感染するβコロナウイルスで、新型コロナウイルスと近縁のウイルスです。マウスコロナウイルスにはいろいろなウイルス株が知られており、ウイルスの組織特異性から腸管型と多臓器型に大別することができると言われています。マウスコロナウイルスJHM株(JHMV)は多臓器型ウイルスの1つで、マウスに腹腔内接種すると軽度のウイルス性急性肝炎を起こします。
【コロナウイルス感染症における細胞傷害性T細胞(CTL)反応】
マウスコロナウイルス感染症の感染防御においては自然免疫と獲得免疫の両方が重要です。久和教授らはCD4+T欠損マウス、CD8+T細胞欠損マウス、CD4+T/CD8+T細胞欠損マウスおよび野生型C57BL/6(B6)マウスを用いて、肝臓からのJHMVの排除と肝炎の抑制においてCD8+T細胞がとくに重要であることを報告しています(文献1)。また、JHMVによる致死性脳炎はJHMV特異的CD8+T細胞クローンの移植により防御されることも報告されており(文献2)、CD8+CTLはコロナウイルスの感染防御に重要な役割を果たしていると考えられます。
【免疫不全マウスにおけるマウスコロナウイルスの持続感染】
免疫系の機能が低下している宿主ではウイルス感染症が長引いたり、重篤化したりすることがよくあります。IFN-γ欠損B6マウスにJHMVを腹腔内接種すると、野生型B8マウスのものよりも重篤な肝炎が起こります。野生型マウスでは1週間後には肝臓からウイルスは排除されますが、IFN-γ欠損マウスではウイルス価は減少するものの排除はされず、持続しました。肝炎はだんだん治癒に向かっていきましたが、腹腔および胸腔に腹水および胸水の貯留を伴う肉芽腫性漿膜炎が発生し、マウスは死亡しました(文献3)。異なる遺伝的背景を持つIFN-γ欠損BALB/cマウスにJHMVを腹腔内接種すると劇症肝炎を発症し、死亡しました。遺伝的背景は感染症の重篤度に関与することが分かります(文献4)。
【IFN-γ欠損マウスにおけるマウスコロナウイルス持続感染のメカニズム】
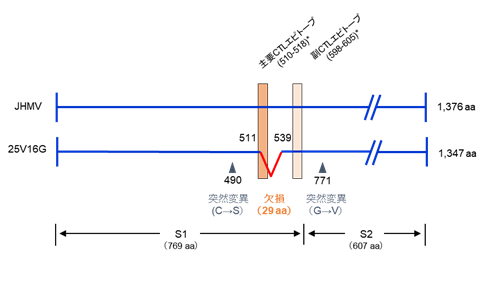
図1 マウスコロナウイルスJHM株(JHMV)および25V16GのSタンパク質の構造とB6マウスのCTLエピトープ
Sタンパク質は分子量180kDaで、S1ドメインとS2ドメインから構成されています。JHMVと比較すると、25V16Gには29アミノ酸残基(511-539)の欠損と2か所の突然変異がありました。JHMVのB6マウスにおける主要CTLエピトープ(510-518)および副CTLエピトープ(598-605)はCastroとPerlmanによって報告されたものです(Castro, R. F. and Perlman, S. 1995. J. Virol. 69: 8127-8131)
久和教授らは感染25日後のマウス腹腔内からウイルスを分離・クローン化し、25V16Gと名付けました。25V16GとJHMVのin vitroでの増殖性を比較したところ、3つの培養細胞株(DBT細胞、IC-21細胞、J774A.1細胞)におけるウイルス増殖性には差はありませんでした。両ウイルスのS遺伝子の塩基配列を比較したところ、25V16Gには87塩基の欠損および2つの突然変異がありました。興味深いことに、87塩基の欠損はB6マウスの主要CTLエピトープ(注3)を含んでおり、B6マウスでは25V16GはCTLに認識されにくいCTL抵抗性ウイルスであることが示唆され、このことがIFN-γ欠損B6マウスにおけるマウスコロナウイルス持続感染に寄与していることが推測されました(図1)。
野生型およびIFN-γ欠損のB6マウスに25V16GおよびJHMVを腹腔内接種して、その病態を比較しました。感染5日後の野生型B6マウスの肝臓での25V16Gのウイルス価はJHMVの約60倍高い値でした。また、IFN-γ欠損マウスは25V16G接種により劇症肝炎を発症し、25V16Gの病原性はJHMVよりも高いことが示され、25V16GがCTL抵抗性であることが重篤化と関連することが示唆されました(文献5)。
【CTLとIFN-γのマウスコロナウイルス関連疾患における役割】
一連の実験結果をまとめたものが図2です。
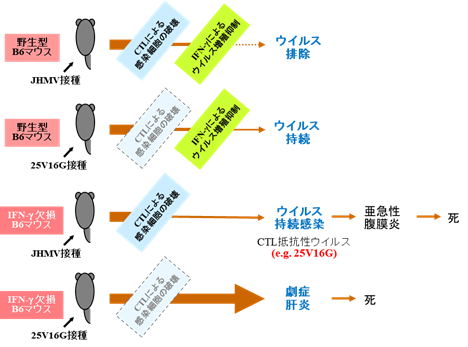
図2 一連の実験結果をまとめた図
・野生型B6マウスにJHMVを腹腔内接種すると軽度の急性肝炎を発症しましたが、CTL、IFN-γ、その他の機序により1週間以内にウイルスは肝臓から排除されました。
・野生型B6マウスにCTL抵抗性ウイルスである25V16Gを腹腔内接種すると、JHMVとは異なり、1週間では肝臓からウイルスは排除されませんでした。
・IFN-γ欠損B6マウスにJHMVを腹腔内接種すると、野生型B6マウスよりも重篤な肝炎が起こりました。肝臓のウイルス価は接種後5日をピークとし、その後減少しましたが排除されず持続しました。肝炎は治癒に向かいましたが、亜急性肉芽腫性漿膜炎を発症し、ほとんどのIFN-γ欠損B6マウスは死亡しました。また、亜急性肉芽腫性漿膜炎を発症しているIFN-γ欠損B6マウスからCTL抵抗性ウイルス25V16Gが分離されました。
・IFN-γ欠損B6マウスにCTL抵抗性ウイルスである25V16Gを腹腔内接種すると、ウイルスは肝臓で急激に増殖し、劇症肝炎を発症し、マウスは死亡しました。
【展望】
感染症の病理発生機序を解明することはワクチン開発において必須であり、動物を用いた疾患モデルは病理発生機序の理解に役立ちます。マウスコロナウイルス感染症はCOVID-19 を含めたヒトのコロナウイルス感染症の病理発生機序、とくにウイルスと宿主の免疫機構の間の相互作用に関するヒントを提示しているものと考えられます。COVID-19に対するワクチン開発が進んでいますが、ウイルス特異的CTLを誘導できるワクチンが有望だろうと考えられます。 COVID-19においてもIFN-γ欠損B6マウスで見られたようなCTL抵抗性SARS-CoV-2が出現しているのか検討してみる必要があるかもしれません。また、適当な抗ウイルス剤が存在するならば、それを急性期に投与しウイルス増殖を抑制することによって、CTL抵抗性SARS-CoV-2の出現を抑えることができるかもしれず、検討に値すると考えます。
文献1: Kyuwa, S. et al. 1996. Exp. Anim. 45: 81-83.
文献2: Yamaguchi, K. et al. 1991. J. Neuroimmunol. 32: 1-9.
文献3: Kyuwa, S. et al. J. Virol. 72: 9286-9290.
文献4: Kyuwa, S. et al. 2002. Virus Res. 83: 169-177.
文献5: Kyuwa, S. et al. 2010. Viral Immunol. 23: 437-442.
発表雑誌
- 雑誌名
- 「Journal of Veterinary Medical Science」(2020年8月5日公開)
- 論文タイトル
- Role of cytotoxic T lymphocytes and interferon-γ in coronavirus infection: lessons from murine coronavirus infections in mice
- 著者
- Shigeru Kyuwa* and Yuki Sugiura
- DOI番号
- 10.1292/jvms.20-0313
- 論文URL
- www.jstage.jst.go.jp/article/jvms/advpub/0/advpub_20-0313/_article/-char/en
問い合わせ先
東京大学大学院農学生命科学研究科 獣医学専攻 実験動物学研究室 教授 久和 茂(きゅうわ しげる)
Tel: 03-5841-5038 e-mail: akyuwa1<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 細胞傷害性T細胞(cytotoxic T lymphocyte、CTL) リンパ球であるT細胞の一種で、宿主にとって異物(つまり、非自己)となるウイルス感染細胞や癌細胞などを、T細胞受容体を介して認識し破壊します。キラーT細胞ともよばれています。通常、細胞表面にCD8分子を発現しています。
- 注2 インターフェロン-γ(interferon-γ,IFN-γ) II型インターフェロンともよばれています。活性化したNK細胞、NKT細胞、T細胞などから放出される抗ウイルス性サイトカインで、免疫調節作用も併せ持っています。
- 注3 CTLエピトープ T細胞受容体はウイルス感染細胞の主要組織適合抗原(MHC)クラスI分子とウイルスペプチドの複合体を認識します。MHCクラスI分子と複合体を形成するウイルスペプチドをCTLエピトープといいます。MHCクラスI分子には多様性があり、またそれぞれのMHCクラスI分子と複合体を形成するウイルスペプチドは異なります。したがって、ヒトではCTLエピトープは個人によって異なります。

