細胞老化によるデュシェンヌ型筋ジストロフィーの病態悪化 〜デュシェンヌ型筋ジストロフィーに対する新規治療標的の発見〜
- 発表者
- 杉原 英俊 (東京大学大学院農学生命科学研究科 獣医学専攻 博士課程4年生)
寺本 奈保美 (東京大学大学院農学生命科学研究科 獣医学専攻 博士課程:研究当時)
中村 克行 (帝人株式会社)
志賀 崇徳 (東京大学大学院農学生命科学研究科 獣医学専攻 博士課程:研究当時)
白川 卓 (神戸学院大学 総合リハビリテーション学部 研究員)
松尾 雅文 (神戸学院大学 総合リハビリテーション学部 特命教授)
小笠原 真志 (国立精神・神経医療研究センター MGCゲノム診療開発部 流動研究員)
西野 一三 (国立精神・神経医療研究センター 疾病研究第一部 部長)
松脇 貴志 (東京大学大学院農学生命科学研究科 獣医学専攻 准教授)
西原 眞杉 (東京大学大学院農学生命科学研究科 獣医学専攻 名誉教授)
山内 啓太郎 (東京大学大学院農学生命科学研究科 獣医学専攻 准教授)
発表のポイント
- 筋ジストロフィーモデルラットの筋肉では、細胞老化に関係する因子の発現が上昇しており、遺伝学的手法によって細胞老化を抑制することで病態が改善することを見出した。
- このラットに老化した細胞を除去する薬剤ABT263を投与したところ、病態の進行が抑制された。
- 以上の知見は、デュシェンヌ型筋ジストロフィーの病態進行機序解明や治療法開発に貢献すると期待される。
発表概要
東京大学大学院農学生命科学研究科の杉原英俊大学院生、寺本奈保美大学院生、山内啓太郎准教授らの研究グループは、デュシェンヌ型筋ジストロフィー(DMD)の病態悪化に細胞老化という現象が関与することを世界で初めて見出しました。
細胞は分裂を繰り返すうちにやがて分裂限界に達し、p16などの細胞分裂抑制因子を発現することで分裂を停止することが知られています。この現象を細胞老化といいます。近年では、細胞老化は、分裂を繰り返す以外に、炎症などのストレス環境にさらされることによっても誘導されることが明らかになってきました。
DMDはX染色体上に存在するジストロフィン遺伝子のout-of-frame変異(注1)により引き起こされる遺伝性の難病で、筋肉の持続的な損傷や炎症を特徴とします。研究グループは、2014年にジストロフィン遺伝子にout-of-frame変異をもつ筋ジストロフィーモデルラット(DMDラット(注2))を独自に開発しました。今回、同グループは持続的な炎症が見られるDMDラットの筋肉では、病態悪化とともにp16の発現が増加し、細胞老化が誘導されていることを明らかにしました。細胞老化を抑制するために遺伝学的な手法を用いてp16を欠損させたところ、体重・筋力の改善や、DMDに特徴的な筋肉の線維化や脂肪化の減少など、全身的な病態の改善が見られました。
さらに、研究グループは老化細胞を特異的に除去できる薬剤ABT263に着目しました。DMDラットにABT263を投与したところ、老化細胞数が減少し、病態悪化に伴ってみられる体重減少や筋力低下が抑制されました。
最後に、研究グループはヒトDMD患者の筋肉においても、p16などの細胞老化に関連する因子の発現が上昇していることを見出しました。この結果は、ヒトDMD患者でもDMDラットと同様に細胞老化が病態悪化に関与する可能性を示しており、本研究成果はDMDの病態進行機序の解明や、治療法開発に貢献することが期待されます。
発表内容
DMDはX染色体上に存在するジストロフィン遺伝子の変異により引き起こされる遺伝性の筋原生疾患です。ジストロフィン遺伝子から作られるジストロフィンタンパク質は筋線維細胞膜の安定化に関わる重要な因子で、同遺伝子のout-of-frame変異によりジストロフィンタンパク質が全く作られないDMDでは筋肉の持続的な損傷や炎症を特徴とします。
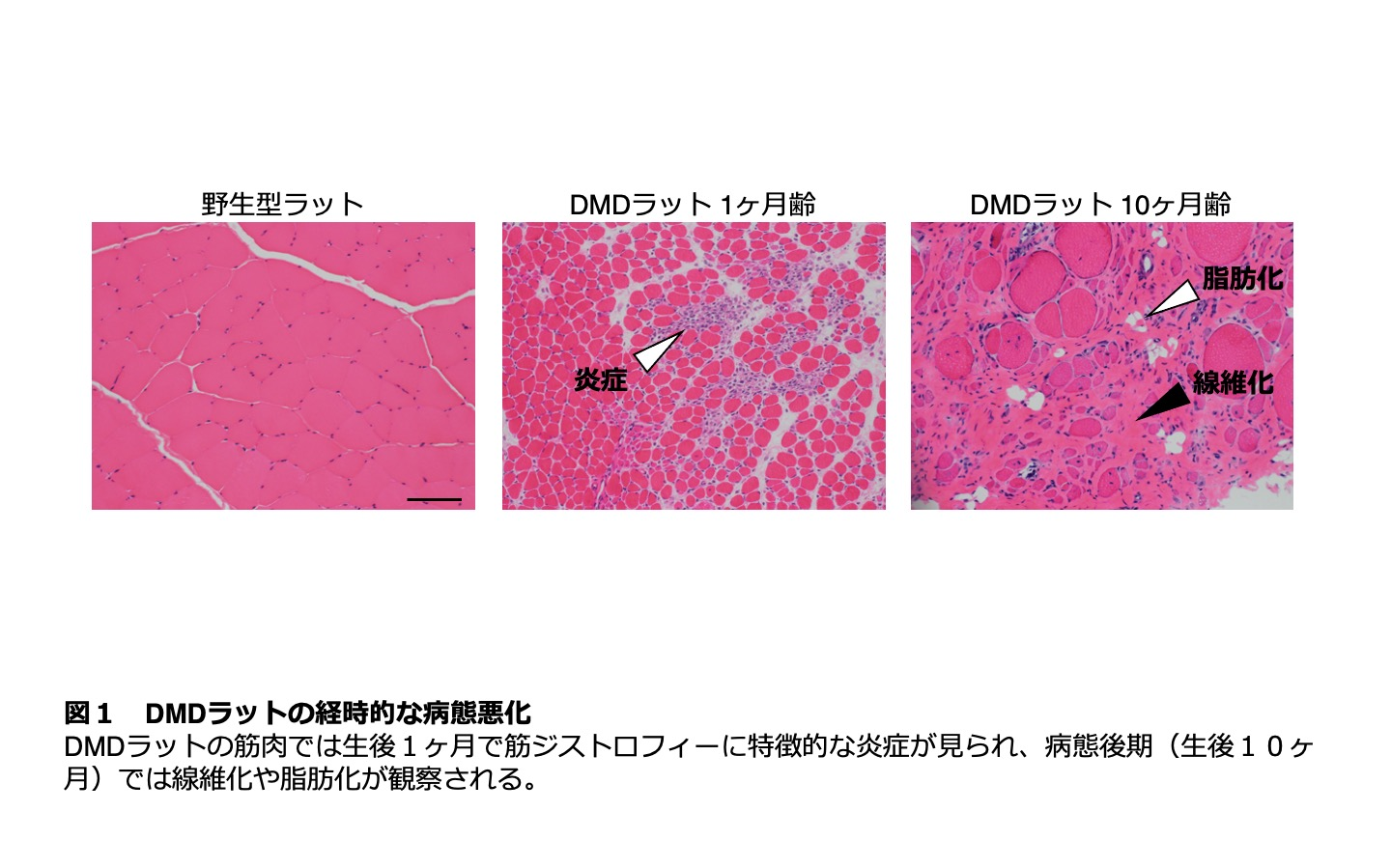
研究グループは2014年にCRISPR/Cas法(注3)を用いて、ジストロフィン遺伝子に変異をもつラットを複数作製することに成功しました。それらを系統化したところ、1つの系統では、ジストロフィン遺伝子にout-of-frame欠損が生じており、その結果、筋肉ではジストロフィンタンパク質の発現が消失していました。このラットの病態を経時的に評価したところ、進行性の体重減少や筋力の低下に加えて、病態後期では筋肉の線維化や脂肪化が顕著になる(図1)など、ヒト筋ジストロフィー患者に類似した重篤な表現型を示すことが分かりました。そこで、研究グループはこのラットをDMDの病態を適切に反映したDMDラットと位置づけ、病態悪化機序の解明に取り組みました。
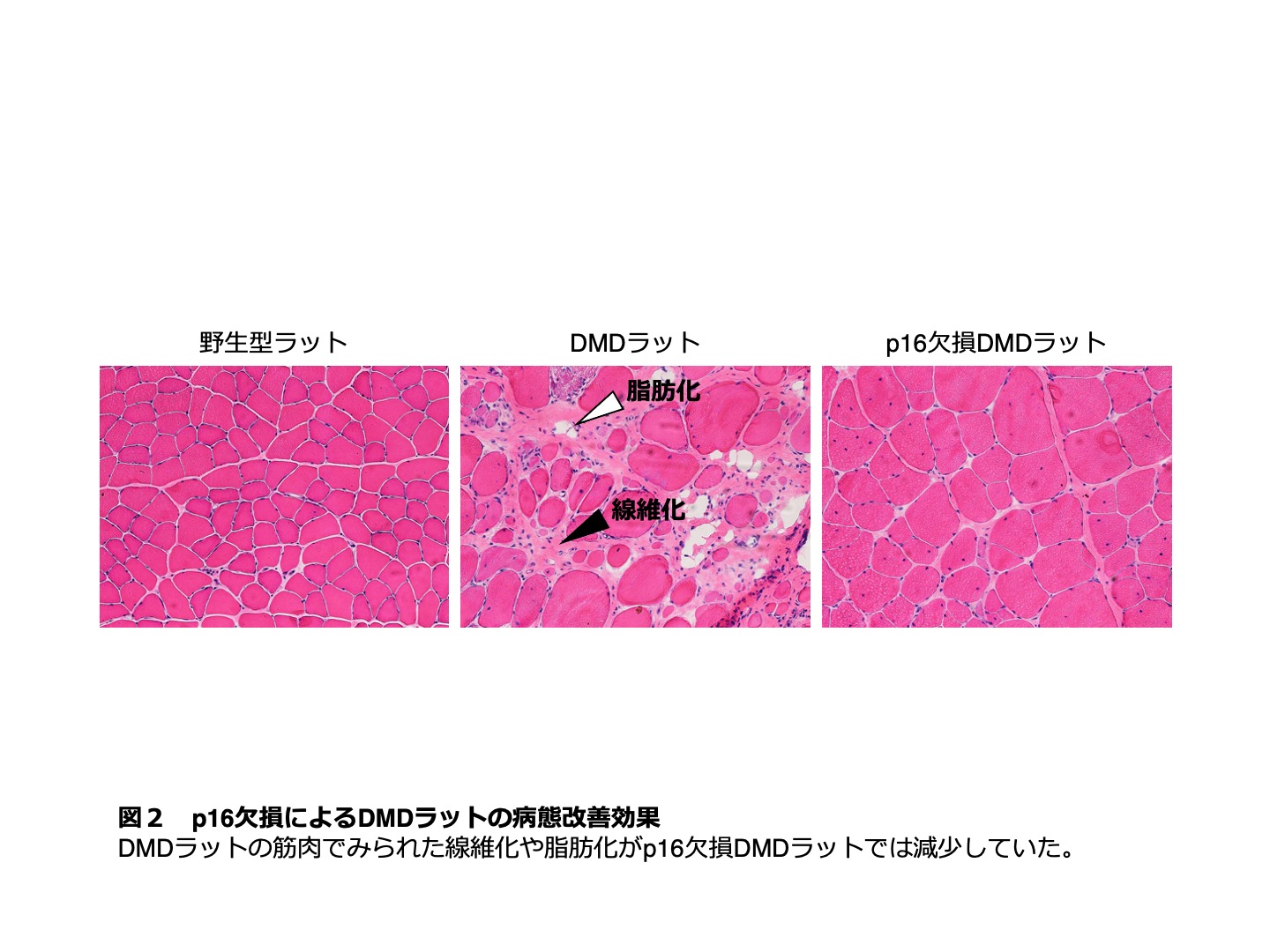
細胞は分裂を繰り返すうちにやがて分裂限界に達し、p16などの細胞分裂抑制因子を発現することで分裂を不可逆的に停止することが知られています。この現象を細胞老化といいます。これまで、細胞老化は培養細胞などでのみ観察される特殊な現象であると考えられてきました。しかし、近年、細胞老化は炎症などのストレス環境によって、生体内でも誘導されることが明らかになってきました。さらに老化した細胞は分裂を停止するだけでなく、細胞自身の性質が変化し、様々な液性因子を分泌することで、周囲の細胞に悪影響を与えることもわかってきています。研究グループは、持続的な炎症が見られるDMDラットの筋肉では、病態悪化とともにp16の発現が亢進し、細胞老化が誘導されていることを明らかにしました。そこで、研究グループは、p16の発現を欠損させて細胞老化を抑制することを目的として、CRISPR/Cas法を用いてp16遺伝子にout-of-frame欠損を持つラットを作成し、これをDMDラットと交配させることでp16欠損DMDラットを作出しました。p16欠損DMDラットは、通常のDMDラットに比べて体重・筋力の改善や、筋肉中の線維化や脂肪化の減少など全身的な病態の回復が認められました(図2)。
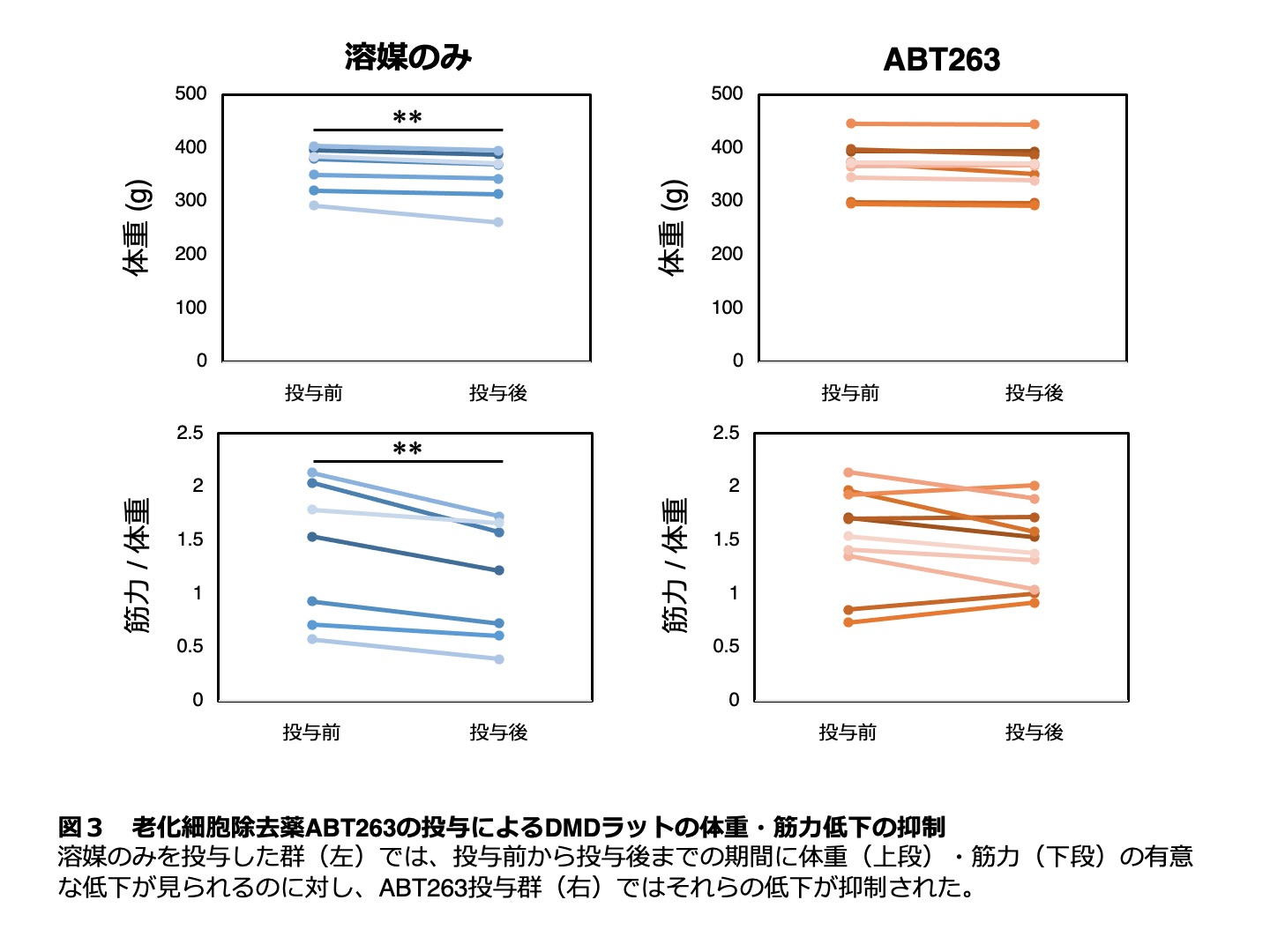
p16の欠損により細胞老化を抑制することができますが、同時に癌化のリスクを増大させてしまうという欠点があり、実際の治療に応用するためには解決すべき課題が残ります。そこで、研究グループは別の手法として、薬剤を用いて老化細胞を除去することを試みました。ABT263という薬剤は老化した細胞特異的にアポトーシス(注4)を誘導することで、生体から老化細胞を除去することが知られています。DMDラットにABT263を経口投与したところ、筋肉中の老化細胞の数が減少することが確認されました。さらに、ABT263の投与によって筋肉を構成する筋線維が太くなるとともに、病態悪化に伴って通常見られるはずの体重・筋力の減少が抑制されることが明らかになりました(図3)。以上より、細胞老化を遺伝学的手法や薬剤によって抑制することで、DMDの病態が改善することが示されました。
最後に、研究グループはヒトDMD患者の筋肉においても、p16や、その他の細胞老化に関連する因子の発現が上昇していることを見出しました。この結果は、ヒトのDMD患者でもDMDラットと同様に細胞老化が病態悪化に関与する可能性を示していると考えられます。
現在、DMDの治療法として、ステロイドのみが唯一有効な薬剤として使用されています。近年では、新たなDMDの治療法として、ジストロフィン遺伝子のout-of-frame型の変異をin-frame型の変異へと置換するエクソン・スキップとよばれる遺伝子治療法の開発も進められていますが、DMD患者の遺伝子変異のパターンによっては使用できない場合もあります。本研究では、細胞老化がDMDの新たな治療ターゲットである可能性を明らかにしました。今後の研究によって細胞老化の抑制や老化細胞の除去がヒトDMD患者でも有効であることが判明すれば、現在開発が進んでいる治療法に新たな選択肢を加えることで治療の幅を広げることが期待されます。また、老化細胞がDMDの病態悪化に関与する詳細なメカニズムを明らかにすることができれば、さらなる治療標的の開発にも結びつく可能性が考えられます。
なお、本研究は、日本学術振興会科学研究費補助金(基盤研究(B)16H05041、挑戦的萌芽研究15K14883)、国立研究開発法人日本医療研究開発機構・創薬総合支援事業「筋萎縮症の新規治療法開発」、国立研究開発法人 国立精神・神経医療研究センター 精神・神経疾患研究開発費(29-4、2-5)の支援を受けて行われました。
発表雑誌
- 雑誌名
- Scientific Reports (10月12日(月))
- 論文タイトル
- Cellular senescence-mediated exacerbation of Duchenne muscular dystrophy
- 著者
- Hidetoshi Sugihara, Naomi Teramoto, Katsuyuki Nakamura, Takanori Shiga, Taku Shirakawa, Masafumi Matsuo, Masashi Ogasawara, Ichizo Nishino, Takashi Matsuwaki, Masugi Nishihara and Keitaro Yamanouchi* *責任著者
- DOI番号
- DOI : 10.1038/s41598-020-73315-6
問い合わせ先
東京大学大学院農学生命科学研究科 獣医学専攻 獣医生理学教室
准教授 山内 啓太郎(やまのうち けいたろう)
Tel:03-5841-5387 Fax:03-5841-8017
E-mail:akeita<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 out-of-frame変異
塩基の欠失または挿入により、アミノ酸をコードする3つ組みの読み枠がずれる変異。多くの場合、遺伝暗号(コドン)にずれが生じることで、翻訳の際のアミノ酸が変わり、より手前で終止コドンが現れたりする。 - 注2 DMDラット
研究グループが2014年に作製したジストロフィンタンパク質を完全に欠損したラット。ヒトDMDと同様の病態を示す。 (文献)Nakamura K, Fujii W, Tsuboi M, Tanihata J, Teramoto N, Takeuchi S, Naito K, Yamanouchi K, Nishihara M. Generation of muscular dystrophy model rats with a CRISPR/Cas system. Sci Rep 4: 5635 (2014) - 注3 CRISPR/Cas法
DNAを切断する酵素と標的とする遺伝子の一部と相補的な配列をもつガイドRNAを用いることで、標的部位に変異を導入する遺伝子改変技術の一つ。 - 注4 アポトーシス
細胞が様々な化学的、生物学的因子に応答して誘発される自死反応。