枝をよけながら幹を切る:複雑な糖鎖を分解できる酵素のユニークな構造
- 発表者
- 松 山 佳 織(東京大学大学院農学生命科学研究科生物材料科学専攻 博士課程学生)
岸 根 尚 美(農研機構高度解析センター生体高分子解析チーム 研究員)
藤 本 瑞(農研機構高度解析センター生体高分子解析チーム チーム長)
砂 川 直 輝(東京大学大学院農学生命科学研究科生物材料科学専攻 特任助教)
小 竹 敬 久(埼玉大学大学院理工学研究科 教授)
円 谷 陽 一(埼玉大学大学院理工学研究科 名誉教授)
鮫 島 正 浩(東京大学大学院農学生命科学研究科 名誉教授/信州大学工学部 特任教授)
五十嵐 圭日子(東京大学大学院農学生命科学研究科生物材料科学専攻 准教授/VTTフィンランド技術研究センター 客員教授)
金 子 哲(琉球大学農学部亜熱帯生物資源科学科 教授)
発表のポイント
- 植物のアラビノガラクタンプロテイン(AGP)糖鎖を分解するきのこのガラクタン分解酵素Pc1,3Gal43Aの立体構造を、真菌由来の酵素として初めて明らかにしました。
- Pc1,3Gal43Aは、複雑なAGP糖鎖の側鎖をよけながら主鎖を分解できるユニークな形をしており、同様の活性を示す他の酵素でもその形が保存されていることが分かりました。
- 本研究成果は、複雑なAGP糖鎖の構造解析や機能解析だけではなく、バイオマス分解や有用なオリゴ糖の生産などの様々な分野に活用できると考えられます。
発表概要
AGPは植物が生産するプロテオグリカン(注)の一つで、植物の生理機能に広く関与していることが知られていますが、その糖鎖構造の複雑さからAGPの機能の全容は明らかになっていません。本研究では、AGP糖鎖を分解できるきのこの酵素に着目してX線結晶構造解析を行い、この酵素がどのようにして複雑なAGP糖鎖を分解するのかを立体構造から明らかにしました。本研究成果は生化学や分子生物学分野の学術誌として長い歴史をもつJournal of Biological Chemistry誌に掲載されました。
発表内容
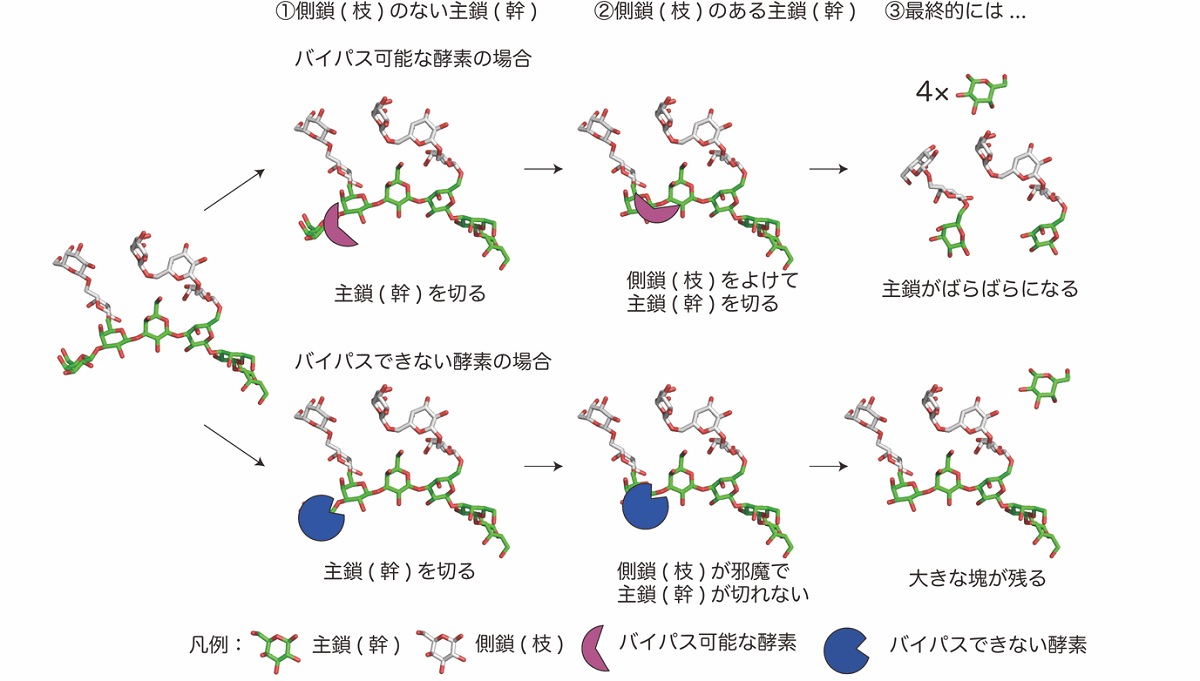
図1 AGP糖鎖分解の模式図
側鎖をバイパス可能な酵素(上段)とバイパスできない酵素(下段)の酵素反応の経過と最終産物を模式的に示した図です。①のように枝(水色)がない時にはどちらの酵素も幹(緑)を切ることができます。しかしながら②のように枝がついている場合にはバイパス可能な酵素(マゼンタ)は枝をうまくよけて幹を切断できますが、バイパスできない酵素(青)はうまく枝をよけられないために幹を切ることができません。最終的には③のようにバイパス可能な酵素では幹が切られてばらばらになりますが、バイパスできない酵素では末端しか幹を切れずに大きな塊が残ります。したがって、枝をよけられる酵素を用いれば幹(主鎖)にどんな枝(側鎖)がどのくらいついているのか推定することができるため、AGP糖鎖の構造を調べるのにとても役立ちます。
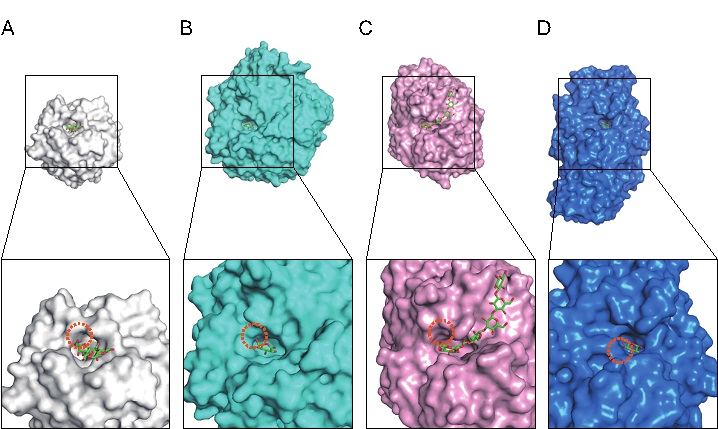
図2 Pc1,3Gal43A(A)、きのこ由来β-1,3-グルカナーゼ(B)、細菌由来β-1,3-グルカナーゼ(C)、糸状菌由来β-1,3-グルカナーゼ(D)における触媒ポケットの構造比較
上段は触媒ドメインの全体構造図、下段は触媒ポケットの拡大図であり、オレンジ色の破線の丸印は着目している非還元末端の糖(ガラクトースまたはグルコース)の隣の空間を示しています。いずれもβ-1,3-結合した糖鎖を端から分解する酵素で、A、B、Cはβ-1,6-結合した側鎖をバイパスして主鎖を分解することができますがDは側鎖が結合していると主鎖を分解できません。A、B、Cではいずれも非還元末端側の糖の6位メチロール基の隣に空間(オレンジ点線丸部分)が存在します。一方Dでは6位メチロール基が酵素の壁の方向に向いており、側鎖が結合していた場合にはその糖が酵素に衝突する立体障害を生じてしまいます。したがって、この空間の存在がバイパス活性の有無に重要だと考えられます。
植物細胞の外側には、「細胞壁」という構造体が存在します。細胞壁は細胞質の保護、細胞強度や形の保持など非常に重要な役割を担っており、ブドウ糖(グルコース)が多数結合したセルロースをはじめとする様々な多糖類や、タンパク質や糖タンパク質、プロテオグリカンも含んでいます。プロテオグリカンのなかでも特にAGPは高等植物に広くみられ、細胞膜や細胞壁、細胞間層に存在し、植物の生理機能に深く関与していることが知られています(参考文献1)。しかしながら、AGPの糖鎖構造は非常に複雑で、構造と機能の相関を調べるのは非常に難しいことが知られています。
AGP糖鎖は、主にガラクトースという糖がβ-1,3-グリコシド結合で結合した長い糖鎖(β-1,3-ガラクタン主鎖:幹)に、ガラクトースがβ-1,6-グリコシド結合により結合した糖鎖(β-1,6-ガラクタン側鎖:枝)が分岐した構造をとります(図1)。β-1,6-ガラクタン側鎖には、アラビノースやグルクロン酸などの別の糖がさらに結合しているので、AGP糖鎖の全体構造を明らかにするためにはどのような側鎖が結合しているかを知る必要があります。そのような複雑な糖鎖の構造を明らかにしたい場合、基質特異性が高い酵素を使うことが非常に有用ですが、そのためには反応に用いる酵素の特徴を知っておく必要があります。
今回注目したきのこの一種が作るガラクタナーゼという酵素(Pc1,3Gal43A)は、AGP糖鎖のβ-1,3-ガラクタン主鎖にβ-1,6-ガラクタン側鎖が結合している場合でも、β-1,3-結合を切り落とす「バイパス活性」を示します(図1、参考文献2)。AGPに作用する他の酵素には側鎖が結合していると作用できないものが多いので、本酵素がどのような仕組みで「枝」(β-1,6-ガラクタン側鎖)をよけながら「幹」(β-1,3-ガラクタン主鎖)を切るのかが国内外の研究者の間で議論されていました。そこで今回、Pc1,3Gal43AのX線結晶構造を解き、糖鎖認識メカニズムを調べることにしました。なお、本研究で明らかにした立体構造は糖質加水分解酵素ファミリー43サブファミリー24(GH43_sub24)および糖質結合モジュールファミリー35(CBM35)において真菌由来の酵素およびβ-1,3-ガラクタンに結合性を示すモジュールとしてそれぞれ世界初の構造でした。
Pc1,3Gal43Aはガラクタンの分解に関わる触媒ドメインとガラクタンを認識する糖質結合モジュールの二つのドメインから構成されている酵素で、どちらのドメインにおいてもガラクタンがはまるくぼみ(基質ポケット)がみられました。触媒ドメインに注目すると、末端のガラクトースの6位メチロール基の先が広く開いており、側鎖がはまることができる空間がありました(図2A)。Pc1,3Gal43Aと同様に枝をよけながら幹を切ることができる酵素(図2BとC)と、そのような活性を示さない酵素(図2D)における基質ポケットの構造を比較してみると、バイパス可能な酵素はいずれも末端の糖の隣に同じような空間が存在しているのに対して、バイパスできない酵素には、このような空間が存在しませんでした。したがって、この空間の存在がバイパス活性を示すために非常に重要であるといえます。また、末端以外の糖にも着目してみても、やはりガラクトースの6位メチロール基の先に空間があることから、枝(β-1,6-ガラクタン側鎖)が連続して存在しても幹(β-1,3-ガラクタン)を分解できるPc1,3Gal43Aのユニークな活性が説明できました。なお、このような特徴は、Pc1,3Gal43Aが分類されるGH43_sub24で広く保存されていました。
また、本研究ではAGP糖鎖の分解反応の触媒や糖鎖を認識し固定するために重要なアミノ酸残基を詳細に明らかにしました。これらのアミノ酸残基を他のアミノ酸に変更すると酵素の特性を変化させることが可能となり、本酵素をより有効活用できると期待されます。
以上のように、酵素は目的とする多糖類の複雑な構造の特徴を認識できる構造を有していると明らかにしました。本酵素以外にも様々な酵素を特徴づけ、その糖鎖の認識メカニズムを解明することは、植物細胞壁を構成する糖鎖の構造解析や機能解析といった基礎研究分野のみならずバイオマス分解や有用なオリゴ糖の生産などの様々な分野へ応用可能であると考えています。
本研究の一部は、日本学術振興会基盤研究(B)「きのこのゲノム編集技術を利用した木材腐朽現象の理解とバイオマス変換系の構築」(研究代表者 五十嵐圭日子)、文部科学省科学研究費補助金新学術領域研究「植物の力学的最適化戦略に基づくサステナブル構造システムの基盤創成」(領域代表:奈良先端科学技術大学 出村拓 教授、計画研究代表者:五十嵐圭日子、小竹敬久)およびBusiness Finlandフィンランド卓越教授(FiDiPro)プログラム「Advanced approaches for enzymatic biomass utilization and modification (BioAd)」(五十嵐圭日子)の補助を受けたものです。
発表雑誌
- 雑誌名
- Journal of Biological Chemistry(10月22日オンライン公開)
- 論文タイトル
- Unique active site and subsite features in the arabinogalactan-degrading GH43 exo-β-1,3-galactanase from Phanerochaete chrysosporium
- 著者
- Kaori Matsuyama, Naomi Kishine, Zui Fujimoto, Naoki Sunagawa, Toshihisa Kotake, Yoichi Tsumuraya, Masahiro Samejima, Kiyohiko Igarashi*, and Satoshi Kaneko(*責任著者)
- DOI番号
- doi:10.1074/jbc.RA120.016149
- 論文URL
- https://www.jbc.org/content/early/2020/10/22/jbc.RA120.016149.abstract
問い合わせ先
東京大学 大学院農学生命科学研究科 生物材料科学専攻
准教授 五十嵐 圭日子(いがらし きよひこ)
Tel:03-5841-5258
E-mail:aquarius<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
参考文献
- 1 Tsumuraya Y., Kotake T., 植物のプロテオグリカン,アラビノガラクタン-プロテイン の構造と機能. 生化学. 89(4): 498-507 (2017)
- 2 Ichinose H., Yoshida M., Kotake T, Kuno, A., Igarashi K., Tsumuraya Y., Samejima M., Hirabayashi J., Kobayashi H., Kaneko S., An Exo-β-1,3-galactanase Having a Novel β-1,3-Galactan-binding Module from Phanerochaete chrysosporium. J. Biol. Chem. 280(27): 25820-25839 (2005)
用語解説
- 注 プロテオグリカン
タンパク質と糖鎖が結合した複合体のうち、糖鎖の占める割合が高い(およそ70 %以上)ものを「プロテオグリカン」といいます。AGPは全体の分子量(大きさ)のおよそ90 %を糖鎖が占めるといわれており、糖の割合が非常に高いプロテオグリカンのひとつとして知られています。一方でタンパク質の割合が糖鎖よりも高いものは「糖タンパク質」とよばれます。

