切られたtRNAがタンパク質合成を止める~新たな翻訳阻害メカニズムの提唱~
- 発表者
- 小川 哲弘(東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
高橋 一敏(東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程:当時)
石田 亘(東京大学大学院農学生命科学研究科応用生命工学専攻 修士課程:当時)
青野 俊裕(東京大学生物生産工学研究センター 講師)
日髙 真誠(東京大学大学院農学生命科学研究科応用生命工学専攻 准教授:当時)
寺田 透(東京大学大学院農学生命科学研究科応用生命工学専攻 准教授)
正木 春彦(東京大学大学院農学生命科学研究科応用生命工学専攻 教授:当時)
発表のポイント
- 大腸菌に作用するタンパク質毒素コリシンDが、アルギニンtRNAを特異的に認識する分子メカニズムを明らかにしました。
- 切断されたtRNAが、リボソームへと運ばれてタンパク質合成を阻害するという、新規メカニズムを提唱しました。
- この新規翻訳阻害メカニズムは、全ての「tRNA特異的リボヌクレアーゼ」に共通するものと期待されます。
発表概要
微生物の世界では、生存競争を勝ち抜くための手段として毒素が利用されます。コリシンDは、大腸菌に作用して細胞内のアルギニンtRNA(tRNAArg)を切断するリボヌクレアーゼ型毒素です。大腸菌には約50種類のtRNAが存在します。これらは配列的にも立体構造的にも互いに似通っておりますが、それにもかかわらず、コリシンDはtRNAArgのみを選択します。我々は、コリシンDがアンチコドンループ配列に基づいてtRNAArgを特異的に認識することを明らかにしました。また、コリシンDにより切断されたtRNAArgがmRNA上でリボソームを停滞させ、これにより翻訳が阻害されることを見出しました。これは予想外の結果であり、新規翻訳阻害機構の提唱につながりました。また、ここで明らかにしたメカニズムは、他のtRNA特異的リボヌクレアーゼにも共通すると考えられます。
発表内容
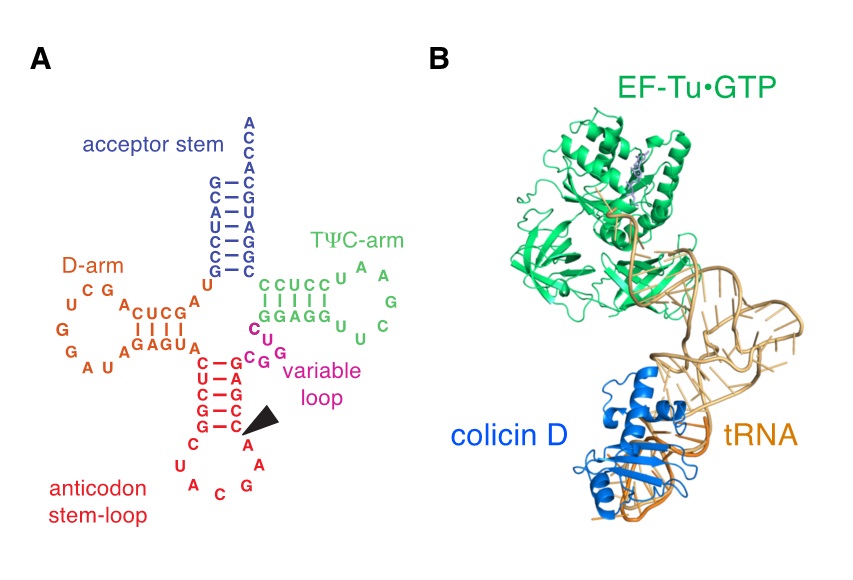
図1 コリシンDによるアルギニンtRNAの認識
(A)コリシンDの主標的であるtRNAArgICGの二次構造を示した(塩基修飾は省略した)。コリシンDによる切断位置を矢印で示した。(B)EF-TuとtRNA、およびコリシンDとのドッキングモデルを示した。今回、分子動力学シミュレーションにより構築したコリシンDとtRNAArgとのドッキングモデルに対し、EF-Tu•GTP•tRNAの結晶構造を重ね合わせた。
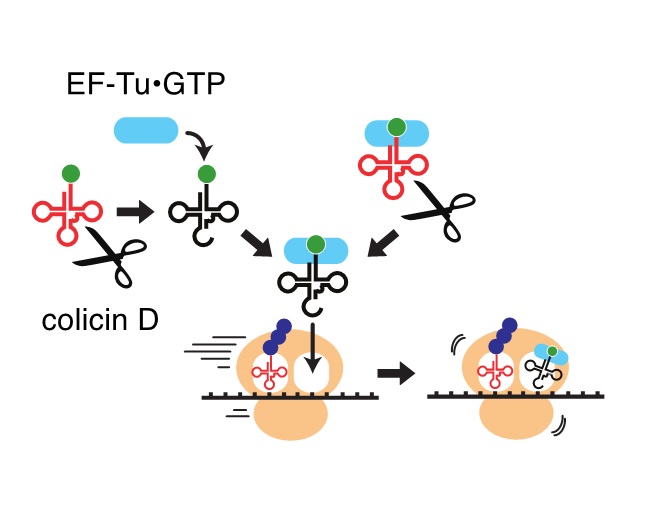
図2 切断されたtRNAがタンパク質合成を阻害するモデル図
微生物は、ニッチでの優位性を獲得するため、常に縄張り争いを繰り広げています。こうした争いに用いる「武器」として、多くの細菌はバクテリオシンと呼ばれる毒素を生産します。このうち、大腸菌およびその近縁種に作用するバクテリオシンはコリシンと呼ばれます。コリシンの標的因子には様々ありますが、我々はtRNAを標的とするタイプのコリシンに注目し、これまで研究を展開してきました。本研究に登場するコリシンDは、大腸菌アルギニンtRNA(tRNAArg)のアンチコドンループ3'末端を特異的に切断するリボヌクレアーゼです(図1A)。大腸菌には、アンチコドンの違いにより4種類のtRNAArgが存在しますが、コリシンDはこれらを全て切断します。
tRNAは「L字型」と呼ばれる似通った構造をとり、かつ分子間で共通する塩基を多数含みます。こうした制約の中で、tRNAはどのように「分子としての個性」を発揮するのでしょうか?この疑問は、これまで多くの研究者を惹きつけてきました。例えば、アミノアシルtRNA合成酵素(ARS)(注1)は、tRNA全体に散らばる、わずか数塩基を巧みに認識して基質tRNAを特異的に選び出します。一方、コリシンDのリボヌクレアーゼドメインはコンパクトであるため、ARSのようにtRNA全体を認識することは不可能です。それにもかかわらず、コリシンDはtRNAArgのみに高い特異性を示すことから、この分子認識メカニズムに興味がもたれました。我々は、切断部位を含むアンチコドンループ近傍をコリシンDが認識すると予想し、変異転写産物を用いた生化学的実験(注2)を行いました。その結果、コリシンDがアンチコドンループ配列を目印に、tRNAArgを特異的に認識することが明らかとなりました。また、4つある大腸菌tRNAArgのうち、細胞内に最も多く存在する分子種(tRNAArgICG)が、コリシンDの主標的であることも分かりました。
この実験過程で、我々は、切断されたtRNAを介した翻訳阻害が予想外のメカニズムに基づくことに気づきました。これまで、正常tRNAArgが切断により枯渇することが、翻訳阻害の原因と想像していました。そうであるならば、tRNAArgの高発現株はコリシンDに耐性となると考えられますが、実際にはそうなりませんでした。一方で興味深いことに、コリシンDによる感受性菌の生育抑制は、切断されたtRNAArgの蓄積量と相関していました。そこで、試験管内タンパク質合成系に切断されたtRNAArgを添加したところ、翻訳が阻害されました。また、アミノ酸と結合したtRNAは、翻訳因子EF-Tu(注3)によりリボソームA部位へと運ばれますが、コリシンDはこのEF-Tuとの競合を避けるようにtRNAを認識・切断することが、生化学的解析、および分子動力学シミュレーション(注4)から明らかになりました(図1B)。更に、感受性大腸菌細胞内で、切断されたtRNAArgICGを人為的に増加させると生育が抑制されること、EF-Tuと結合出来ないように変異させたtRNAArgICGの切断体では、この抑制効果がみられないことが分かりました。以上のことから、切断されたtRNAがEF-TuによりリボソームA部位へと運ばれた結果、mRNA上でリボソームが停滞し、これにより翻訳が阻害されるとのストーリーが考えられました(図2)。コリシンDが、大腸菌tRNAArgの中で細胞内に最も多く存在するtRNAArgICGを主標的とするのは、より多くの切断tRNAをリボソームA部位へと送り込み、翻訳阻害を重篤化させるためと考えられます。
tRNA特異的リボヌクレアーゼは、酵母における「キラー因子」と呼ばれる毒素にも存在します。また、細菌のストレス応答因子である「トキシン-アンチトキシン機構(注5)」などにもみられることから、tRNA切断は細胞増殖制御の手段としても利用されております。興味深いことに、これらリボヌクレアーゼは、アンチコドンループ近傍を重点的に認識します。これはコリシンDと同様、EF-Tuとの競合を避けるためと考えられ、本研究で明らかにしたメカニズムは、tRNA特異的リボヌクレアーゼに共通すると期待されます。
発表雑誌
- 雑誌名
- RNA Biology
- 論文タイトル
- Substrate recognition mechanism of tRNA-targeting ribonuclease, colicin D, and an insight into tRNA cleavage-mediated translation impairment
- 著者
- Tetsuhiro Ogawa*, Kazutoshi Takahashi, Wataru Ishida, Toshihiro Aono, Makoto Hidaka, Tohru Terada, Haruhiko Masaki* (*責任著者)
- DOI番号
- 10.1080/15476286.2020.1838782
- 論文URL
- https://www.tandfonline.com/doi/full/10.1080/15476286.2020.1838782
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 分子育種学研究室
助教 小川 哲弘(おがわ てつひろ)
Tel:03-5841-3079
E-mail:atetsu<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 アミノアシルtRNA合成酵素(ARS)
ATPの加水分解から得られるエネルギーを用いて、tRNAの3'末端に対応するアミノ酸をエステル結合により付加することで、アミノアシルtRNAを合成する酵素。 - 注2 変異転写産物を用いた生化学的実験
tRNAArgのアンチコドンステムループ(図1A)を模したRNAを試験管内で調製する。この際、アンチコドンループの塩基をそれぞれ置換し、これら変異転写産物がコリシンDに切断されるかを調べる。切断されなくなった場合、変異させた塩基をコリシンDが認識すると考える。 - 注3 翻訳因子EF-Tu
アミノ酸を結合したtRNA(アミノアシルtRNA)をリボソームA部位へと運搬する機能を持つ。GTPと結合したEF-Tuは、更にアミノアシルtRNAのアクセプターステム(図1)と結合し、これによりアミノアシルtRNAがリボソームA部位へ運ばれる。コドンとアンチコドンとが正しく対合した後、EF-TuはGTPを加水分解してGDPへと変換し、リボソームから離れる。 - 注4 分子動力学シミュレーション
原子や分子の物理的な動きをPC上でシミュレーションする手法。本研究では、この手法を用いてコリシンDとtRNAArgとのドッキングモデルを構築した。 - 注5 トキシン-アンチトキシン機構
細菌に広く存在する機構であり、エフェクターである「トキシン」と、これの活性を阻害する「アンチトキシン」から構成される。当初はプラスミドの安定性に寄与すると考えられていたが、その後、ストレス応答など幅広い生命現象にかかわることが分かってきた。

