TGF-βシグナル依存的な遺伝子発現の活性化機構の一端を解明~がん治療に応用可能な新規TGF-βシグナル制御法開発への期待~
- 発表者
- 宮園 健一 (東京大学大学院農学生命科学研究科 応用生命化学専攻 養生訓を科学する医食農連携寄付講座 特任准教授)
伊藤 友子 (東京大学大学院農学生命科学研究科 応用生命化学専攻 特任研究員)
深津 由衣 (奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス研究領域)
和田 ひかる (東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程2年:当時)
栗崎 晃 (奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス研究領域 教授)
田之倉 優 (東京大学大学院農学生命科学研究科 応用生命化学専攻 養生訓を科学する医食農連携寄付講座 特任教授)
発表のポイント
- サイトカインの一種であるTGF-βは、がんの悪性化(浸潤や転移)を促進します。
- TGF-βシグナル依存的な遺伝子発現の活性化に重要なタンパク質分子間相互作用の構造基盤を明らかにしました。
- 得られたタンパク質複合体構造を基とした、あらたな創薬研究の展開が期待されます。
発表概要
TGF-βは、細胞の増殖や分化を制御する多機能性のサイトカイン(注1)です。TGF-βシグナルの異常な活性化は、がんの悪性化(浸潤や転移)を誘導することが知られており、そのシグナルの阻害は、がんの治療に有効であると考えられています。SMAD2/3はTGF-βシグナル伝達系において中心的な役割を果たす転写因子であり、転写活性化因子CBPと結合することによって、シグナル依存的に多様な遺伝子の発現を誘導します。
今回、東京大学大学院農学生命科学研究科の田之倉優特任教授を中心とする研究グループは、X線結晶構造解析法(注2)により、SMAD2によるCBPの認識機構を明らかにしました。また、SMAD2に対する結合力を強化した改変型のCBPペプチド断片は、TGF-βシグナル依存的な遺伝子発現の活性化を抑制できることが明らかになりました。
SMAD2/3によるCBP認識機構の構造基盤が明らかになったことにより、構造に基づいた新規TGF-βシグナル阻害剤の開発が可能となりました。得られる新規阻害剤は、がんをはじめとするTGF-βシグナル関連疾患の治療への応用が期待されます。
発表内容
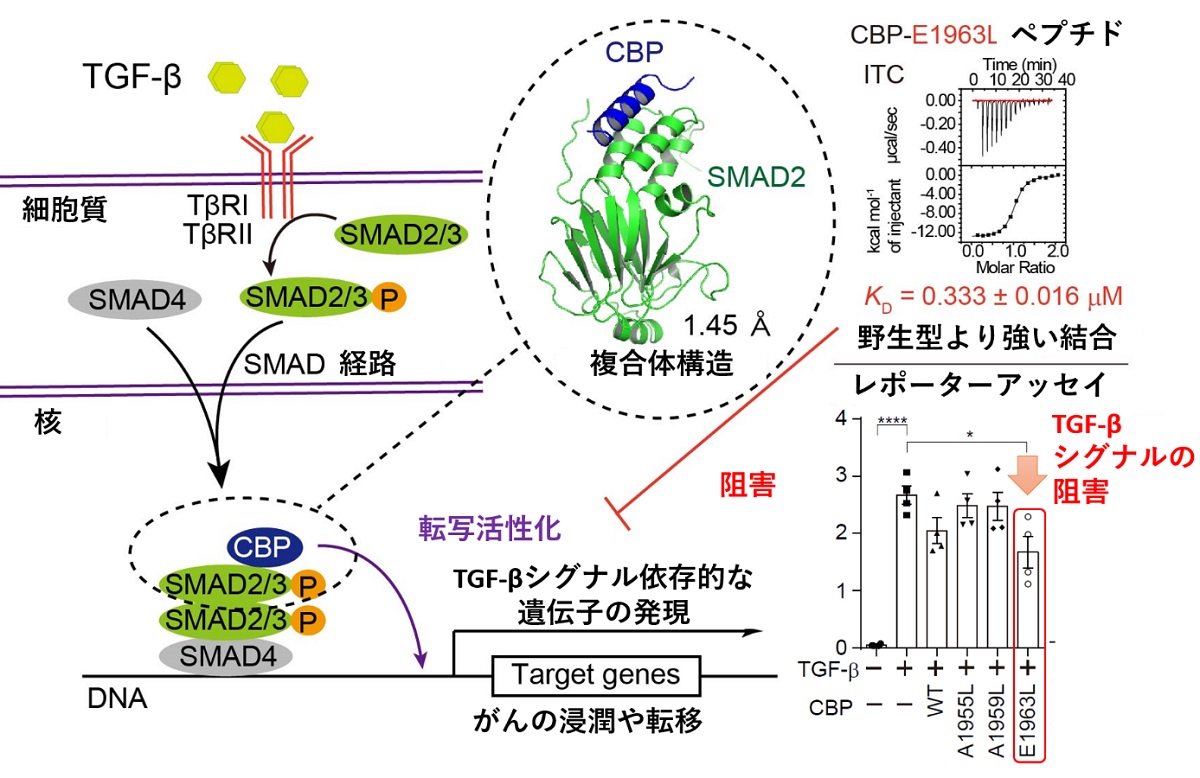
図 SMAD2/3-CBP複合体の解析とその制御
TGF-β依存的な遺伝子発現の活性化には、SMAD2/3-CBP複合体の形成が必要です。今回の研究では、SMAD2-CBP複合体の立体構造をX線結晶構造解析法により決定しました。結合力を強化したCBPペプチド(CBP-E1963Lペプチド)は、TGF-βシグナルを抑制することができます。
トランスフォーミンググロースファクターβ(TGF-β)は、細胞の増殖や分化、細胞死等を制御する多機能性のサイトカインです。そのためTGF-βシグナルの機能不全は、がんや線維症をはじめとする様々な疾病へとつながることが知られています。TGF-βのシグナルは、細胞表層において、SMADと呼ばれる転写因子群のリン酸化へと変換されます。非常に高い相同性を持つ二つのタンパク質SMAD2及びSMAD3(SMAD2/3)は、細胞内におけるTGF-βシグナル伝達系のハブとして作用する主要転写因子で、TGF-βのシグナル依存的に活性化(リン酸化)を受け、様々な遺伝子発現の調節を行います。CREB結合タンパク質(CBP)は、ヒストンのアセチル化を通じて転写の活性化を促すことができる転写活性化因子であり、SMAD2/3依存的な転写の活性化には、CBPが重要な役割を果たしていることが知られています。そこで本研究グループは、SMAD2/3によるCBPの認識機構、つまりSMAD2/3による遺伝子発現活性化にかかわる構造基盤を明らかにすべく、SMAD2-CBP複合体の構造学的な解析を行いました。
転写因子であるSMAD2/3は、N末端側に配列特異的なDNA結合ドメインであるMad homology (MH) 1ドメインを、C末端側にタンパク質分子間相互作用に利用されるMH2ドメインを持ち、そのMH2ドメインを利用してCBPと結合することが知られています。一方、CBPは、そのC末端側に存在する領域を用いてSMAD2/3と相互作用することが知られています。SMAD2によるCBP認識機構の構造基盤を明らかにするため、SMAD2との結合に必要十分なCBPの領域を決定した後、SMAD2-CBP複合体のX線結晶構造解析実験を行いました。SMAD2-CBP複合体の結晶を作製し、大型放射光施設(注3)Photon Factoryのタンパク質結晶構造解析用ビームラインAR-NE3AにてX線回折データの取得を行いました。CBPのSMAD2/3結合領域は、特定の立体構造をとらない無秩序な領域であるとそのアミノ酸配列から予測されていましたが、得られたX線回折データを用いてSMAD2とCBPの複合体構造を決定したところ、CBPは親水的な分子表面と疎水的な分子表面を併せ持つ両親媒性のαヘリックス構造を形成し、その疎水的な分子表面を利用してSMAD2と強く結合することが明らかになりました。また、実験の過程で発見・同定された、SMAD2との結合力が強くなるCBP改変ペプチド(CBP-E1963Lペプチド)を利用することによって、TGF-βシグナル依存的な遺伝子発現の活性化を抑制できることが分かりました。CBP改変ペプチドが、SMAD2/3に対して優先的に結合することにより、CBP依存的な転写の活性化が抑制されたと考えられます(図)。
今回の研究では、TGF-βシグナル依存的な遺伝子発現の活性化機構の構造基盤を明らかにすることができました。過剰なTGF-βのシグナルは、がんの悪性化(浸潤や転移など)を誘導するため、その阻害はがんの治療に有効であると考えられています。TGF-βシグナル依存的な遺伝子発現の活性化は、SMAD2/3とCBPの間の相互作用によって誘導されるため、SMAD2/3-CBP相互作用の阻害剤は、TGF-βシグナルの新たな阻害剤となるはずです。今回SMAD2-CBP複合体の構造をあきらかにできたことにより、構造に基づいた新規TGF-βシグナル阻害剤の開発が可能となりました。得られる新規阻害剤は、がんに代表されるTGF-βシグナル関連疾患の新規治療法の開発へとつながることが期待されます。
本研究は、文部科学省「創薬等支援技術プラットフォーム事業」及び、日本学術振興会科学研究費助成事業 (課題番号 JSPS KAKENHI Grant Numbers 15K14708, 17K19581, 23228003 and 20H02910)の支援を受けて行われました。
発表雑誌
- 雑誌名
- Science Signaling
- 論文タイトル
- Structural basis for the transcriptional coactivator recognition mechanism by SMAD2 in TGF-β signaling
- 著者
- Ken-ichi Miyazono, Tomoko Ito, Yui Fukatsu, Hikaru Wada, Akira Kurisaki and Masaru Tanokura*
- DOI番号
- 10.1126/scisignal.abb9043
- 論文URL
- https://stke.sciencemag.org/content/13/662/eabb9043.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 養生訓を科学する医食農連携寄付講座
特任教授 田之倉 優(たのくら まさる)
Tel:03-5841-5165
Fax:03-5841-8023
E-mail:amtanok<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 サイトカイン
細胞から分泌されるタンパク質で、細胞間の情報伝達を媒介する生理活性物質の総称です。標的細胞にシグナルを伝達し、細胞の増殖・分化、細胞死、免疫、炎症反応の制御等、様々な機能を示します。 - 注2 X線結晶構造解析法
生体高分子の結晶を作製し、そこにX線を照射すると、その結晶に特徴的な回折像が得られます。この回折像は、結晶を形成する分子の構造情報と相関があるので、そのパターンや強度を解析することによって、目的分子の三次元構造を決定することができます。 - 注3 大型放射光施設
生体高分子の立体構造解析の精度は、構造解析の際に用いるX線回折データの品質(分解能)に大きく依存します。正確な立体構造を決定するためには、高品質なX線を利用できる大型放射高施設の利用が欠かせません。

