インスリン受容体mRNA前駆体の肝臓特異的選択的スプライシング機構の解明
- 発表者
-
名倉 貴仁(東京大学大学院農学生命科学研究科応用生命化学専攻 修士課程)
尾添 淳文(東京大学大学院農学生命科学研究科応用動物科学専攻 博士課程)
成田 佑果(東京大学大学院農学生命科学研究科応用動物科学専攻 修士課程)
松尾 雅文(神戸学院大学リハビリテーション学科 特命教授)
伯野 史彦(東京大学大学院農学生命科学研究科応用動物科学専攻 准教授)
片岡 直行(東京大学大学院農学生命科学研究科応用動物科学専攻 准教授)
高橋伸一郎(東京大学大学院農学生命科学研究科応用動物科学・応用生命化学専攻 教授)
発表のポイント
- 動物の代謝を司るホルモン「インスリン」が結合するインスリン受容体 (IR) は、肝臓がん由来細胞で、選択的スプライシング(注1)を受けて、動物の成長を司るホルモン「インスリン様成長因子 (IGF)-II」とも結合するようになることを発見しました。
- 肝臓においてIR-B型の選択的スプライシングが起きるためには、Rbfox2とSRSF3の2種類のスプライシング制御因子(注2)が必要であることが明らかになりました。
- この研究成果は、IR-Aの高発現が知られている、がんや2型糖尿病などの疾病の発症機構の理解の一助となるとともに、疾病の新しい治療薬開発に役立つことが期待されます。
発表概要
インスリン/インスリン様成長因子は、動物の物質代謝を制御する、成長や発達を誘導する、など動物の健康な一生のために必須なホルモンです。インスリンを受容するインスリン受容体 (IR) には、選択的スプライシングによって生じる二つのバリアントIR-AとIR-Bが存在します。IRの選択的スプライシングは種を超えて保存され、発生段階や組織特異的な制御を受けていると考えられています。しかしながら、IRの組織特異的な選択的スプライシング機構については、未解明の部分が多く残されていました。
今回、東京大学大学院農学生命科学研究科の片岡直行准教授、高橋伸一郎教授、伯野史彦准教授らの研究グループは、肝臓でのIR-B型の選択的スプライシング機構をラット肝がん由来細胞H4IIEを用いて解析し、スプライシング制御因子RbfoxとSRSF3がそれぞれエクソン11とイントロン11に結合し、エクソン11の包含を促進することを明らかしました。
この研究成果は、IR-Aの高発現が知られている、がんや2型糖尿病などの疾病の発症機構の理解につながるとともに、疾病の新しい治療薬開発に役立つことが期待されます。
発表内容
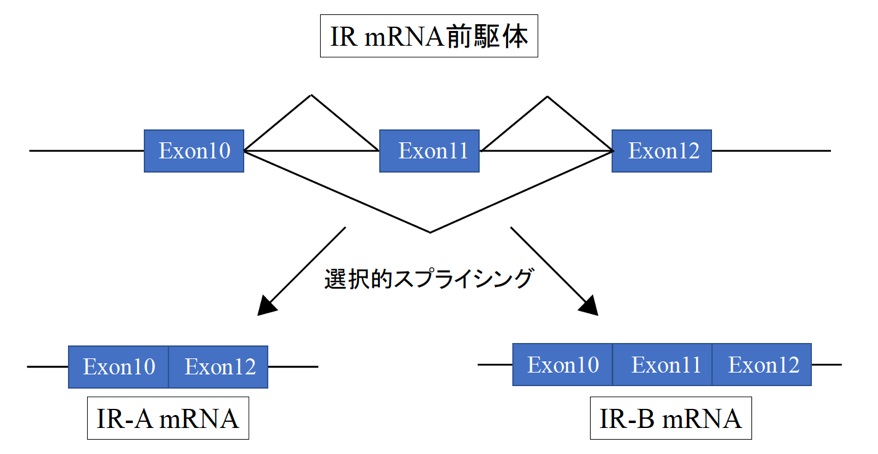
図1 IR mRNA前駆体の受ける選択的スプライシングの模式図。エクソン11の包含または排除によって、それぞれIR-A, IR-B mRNAが産生される。
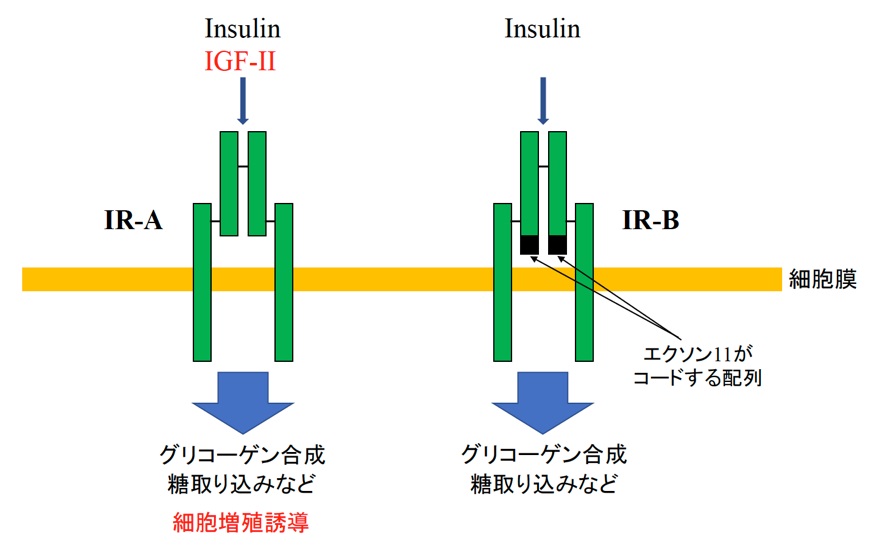
図2 インスリン受容体の二つのバリアント。IR-Bには、細胞膜外の部分にエクソン11がコードするペプチド配列が存在している。IR-Bはインスリンにのみ高い親和性を示すが、IR-AはIGF-IIにも高い親和性を示し、細胞増殖誘導活性を持つと考えられている。
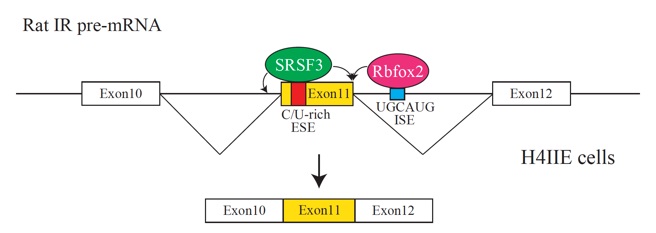
図3 ラットH4IIE細胞内でIR-B型のスプライシングが起きる機構の模式図。SRSF3はエクソン11内に存在するエクソン内スプライシングエンハンサー(ESE)に結合し、Rbfox2はイントロン内に存在するイントロン内スプライシングエンハンサー配列に結合してエクソン11の包含を促進する。
インスリン/インスリン様成長因子(IGF)は、動物の物質代謝を制御する、成長や発達を誘導するなど、動物の健康な一生のために必須なホルモンです。インスリンを受容するインスリン受容体 (IR) には、同一のmRNA前駆体から選択的スプライシングによって生じる二つのバリアントIR-AとIR-Bが存在します(図1)。IR-AとIR-Bの量比は組織によって異なっており、例えば脳を含む神経系では、エクソン11を排除したIR-Aが主に生成するのに対し、ヒト成人肝臓ではエクソン11を包含するIR-Bが主に検出されます。また、これらの選択的スプライシングパターンは、ヒト、ラット、マウスで保存されています。さらに、ヒト胎児肝臓ではIR-AとIR-Bの両方が発現していることから、IRの選択的スプライシングは種を超えて保存され、発生段階や組織特異的な制御を受けていると考えられます。また、IR-Aは、インスリンのみならず、IGF-IIにも結合することが報告されており(図2)、がん化した細胞でIR-Aの発現量が増加していることと併せて、IR-Aの発現と細胞増殖・がん化、2型糖尿病との関連が示唆されています。しかしながら、IRの組織特異的な選択的スプライシング機構については、未解明の部分が多く残されていました。
今回、東京大学大学院農学生命科学研究科の片岡直行准教授、高橋伸一郎教授、伯野史彦准教授らの研究グループは、肝臓でのIR-B型の選択的スプライシング機構を解明する目的で、ラットIR遺伝子の一部を用いたスプライシングレポーター(注3)を作製し、ラット肝がん由来細胞H4IIEに導入しました。そしてレポーター内の様々な領域に欠失を導入して、そのスプライシングパターンを解析したところ、エクソン11の100塩基程度下流の領域がIR-B型選択的スプライシング に必要であることを明らかにしました。そしてこの領域に、スプライシング制御因子Rbfox2の結合配列であるUGCAUGを発見しました。この配列に変異を導入したスプライシングレポーターでは、IR-B型のスプライシングがIR-A型へと大きく変化したこと、また内在性Rbfoxを細胞内でノックダウンすると、内在性IRのスプライシングがIR-A型へと傾くことから、Rbfox2タンパク質がエクソン11下流のイントロンに結合し、エクソン11の包含を促進することでIR-B型のスプライシングを起こすことが明らかになりました。しかし、Rbfox2結合部位に変異を導入したレポーターにおいても、完全にはIR-A型には変化しないこと、Rbfox2タンパク質をほぼ完全にノックダウンしても内在性IRのスプライシングが完全にIR-A型へと変化しないことから、他にもトランス制御因子が存在する可能性が考えられました。そこで、先行研究でIR-B型を促進することが知られていたスプライシング制御因子SRSF3についても解析を行いました。Rbfox2結合部位に変異を導入したスプライシングレポーターにおいて、エクソン11内に存在するSRSF3結合部位にも変異を導入した二重変異レポーターではほぼIR-A型のみが検出されたことから、H4IIE細胞においては、SRSF3とRbfox2がIR-B型の選択的スプライシングには必要であり、それぞれがエクソン11内のエクソン内スプライシングエンハンサー(注4)とイントロン11内のイントロン内スプライシングエンハンサー(注5)に結合してエクソン11の包含を促進することが明らかになりました(図3)。
以上のように、肝臓におけるIR-B型の選択的スプライシングには、二つのスプライシング制御配列とそこに結合するスプライシング制御因子が必要であることが明らかになりました。この機構は他の組織でも働いていることが考えられますが、神経系においては、これらの因子が発現しているにも関わらず、IR-A型になっています。またがんにおいても、これらの因子が存在するにも関わらずIR-Aの比が高くなっています。今後IR-B型の生成機構の成果を基にして、IR-A型が生成するスプライシング機構の解明につなげていきたいと考えています。また、この研究成果は、IR-Aの高発現が知られている、がんや2型糖尿病などの疾病の発症機構の理解の一助となるとともに、疾病の新しい治療薬開発に役立つことが期待されます。
発表雑誌
- 雑誌名
- Biochimie, 187 (2021) 25-32.
- 論文タイトル
- Rbfox2 mediates exon 11 inclusion in insulin receptor pre-mRNA splicing in hepatoma cells
- 著者
- Nakura, T., Ozoe, A., Narita, Y., Matsuo, M., Hakuno, F., Kataoka, N.* and Takahashi, SI.* (*責任著者)
- DOI番号
- doi.org/10.1016/j.biochi.2021.05.007
- 論文URL
- https://www.sciencedirect.com/science/article/pii/S0300908421001255
問い合わせ先
東京大学大学院農学生命科学研究科 応用動物科学専攻 細胞生化学研究室
准教授 片岡 直行 (カタオカ ナオユキ)
Tel:03-5841-5372
E-mail:akataoka<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 選択的スプライシング
核内でゲノムDNAから転写されたmRNA前駆体からイントロンを除去し、エクソン同士を結合させてmRNAを作る過程のことをスプライシングと呼ぶ。スプライシングの様式の一つで、いくつかのエクソンの使用を使い分けることで、1種類のmRNA前駆体から複数種類のmRNAを産生する過程を選択的スプライシングという。 - 注2 スプライシング制御因子
mRNA前駆体に結合し、エクソンの選択やスプライシング複合体の形成を制御する因子。 - 注3 スプライシングレポーター
ある遺伝子のスプライシングパターンを解析する目的で、他の遺伝子由来のエクソンとイントロンの領域を組み込んだプラスミドDNAに解析したい遺伝子の一部を挿入したもの。プラスミドDNAのイントロン部分に解析したい遺伝子の選択的スプライシングを受ける領域を挿入し、培養細胞に導入して用いる。 - 注4 エクソン内スプライシングエンハンサー
エクソン配列中に存在し、その配列を持つエクソンの包含を促進する配列。 - 注5 イントロン内スプライシングエンハンサー
イントロン内に存在し、その近傍に位置するエクソンの包含を促進する配列。

