小胞体膜タンパク質INSIGが酸化ステロールを結合し、転写因子ATF4の発現上昇を介して細胞死を誘導する機構を解明
- 発表者
- 渡邉 雄一(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任助教:当時)
佐々木 崇(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任助教)
三吉 翔子(東京大学大学院農学生命科学研究科 応用生命化学専攻 大学院生:当時)
清水 誠(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任准教授)
山内 祥生(東京大学大学院農学生命科学研究科 応用生命化学専攻 准教授)
佐藤 隆一郎(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
発表のポイント
- 酸化ステロールが細胞死を引き起こす過程に小胞体膜タンパク質INSIGが必須であることを示しました。
- INSIGが酸化ステロールを結合し、PERK-eIF2α-ATF4経路を介してアポトーシス関連因子の発現上昇を引き起こすことが明らかになりました。
- コレステロールの異化中間産物である酸化ステロールが脂質代謝制御以外に、アポトーシスを亢進させ、細胞死を招くという新たな生理作用機構が示されました。
発表概要
コレステロールは細胞膜の主要な構成成分であると同時にステロイドホルモン、ビタミンDの前駆体として多様な生命現象に関与する脂質成分です。私たちの体内でコレステロールは分解・燃焼されることはなく、肝臓で胆汁酸へと異化され、最終的に糞中へと排出される運命をたどります。その過程でコレステロールに水酸基が付加され、一時的に酸化ステロールとして存在します。中でも25位に水酸基が付加された25-hydroxycholesterol (25HC)は種々の生理作用を発揮することが知られています。コレステロール代謝を包括的に制御する転写因子SREBPの活性化を抑制し、コレステロール合成経路の律速酵素HMG CoA還元酵素の分解を促進し、最近ではウイルス感染を抑制する効果が明らかにされています。さらに酸化ステロールは細胞死を導くことが知られており、その際には細胞ストレスを感知してストレス応答因子であるATF4(注1)発現が上昇することが報告されてきました。今回、農学生命科学研究科応用生命化学専攻・食品生化学研究室の佐藤隆一郎教授らのグループは、主要な酸化ステロールである25HCを小胞体膜タンパク質INSIG(注2)が認識することにより、小胞体ストレス応答経路の一つであるPERK(注3)-eIF2α-ATF4経路が活性化され、一連のアポトーシス因子の発現が上昇し、細胞死が進行することを分子細胞生物学的手法で明らかにすることに成功しました。
発表内容
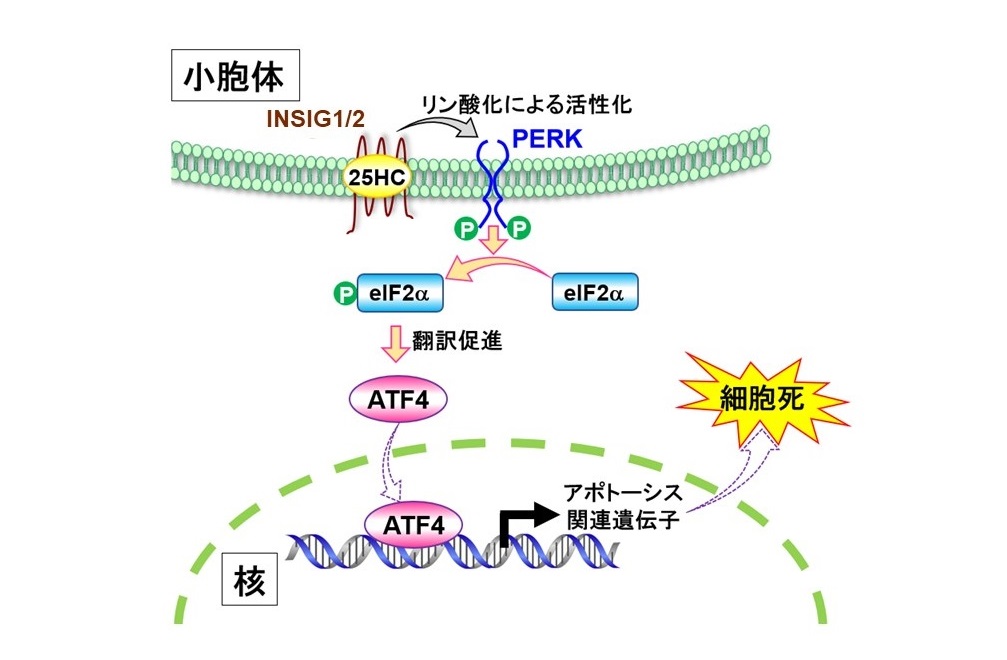
25HCがINSIGを介してATF4発現を上昇させ、細胞死を誘発する概略図
小胞体膜タンパク質INSIGが酸化ステロールを結合、認識し、PERK-eIF2α-ATF4経路を活性化して、アポトーシスによる細胞死を促す。 25HC: 25-hydroxycholesterol
生体内では25位に水酸基を持つ25HC、27位の27HCが生理機能を有する主な酸化コレステロールとして挙げることが出来ます。これらを特異的に結合する因子としては小胞体膜上の膜タンパク質INSIG、OSBPを初めとする複数の酸化ステロール結合タンパク質が見出されています。本研究を開始する時点で25HCが転写因子ATF4発現を上昇させることが明らかにされており、ATF4は小胞体ストレス応答の下流に位置することから、小胞体近傍で酸化ステロールを感知するシステムが働いていることが予想されました。そこで佐藤隆一郎教授、渡邉雄一特任助教のグループは、小胞体膜タンパク質INSIGが25HCとATF4を結び付ける因子であるという仮説を立てました。INSIGは構造の酷似したINSIG1とINSIG2が存在しますが、その両方を欠損したCHO細胞株と野生型CHO細胞と比較することにより解析を進めました。欠損細胞は25HCを添加した培地で培養しても、野生型CHO細胞のようにATF4タンパク質発現が十分に上昇しないことを見出しました。そこで遺伝子導入法により欠損細胞にINSIG1または2を過剰発現させると、25HC添加によるATF4の上昇が回復しました。INSIG1もしくはINSIG2を欠損したヒト肝がんHuh7細胞をCRISPR/Cas9法で作成したところ、内因性INSIGのどちらか一方を欠損すると25HC に応答しなくなることも確認されました。つまり細胞内に取り込まれた25HCを小胞体膜上のINSIG1/2が結合、認識することにより、ストレス応答がATF4発現により制御されることが明らかになりました。INSIGからATF4へとつながる経路を分子細胞生物学的手法により解析した結果、小胞体膜タンパク質のPERKがリン酸化されることにより活性化され、その結果、翻訳開始因子のeIF2αがリン酸化され、その下流のATF4の翻訳が上昇する機構が明らかとなりました。最終的にはATF4がCHOP、TRB3などのアポトーシス関連因子の発現を積極的に誘導し、細胞死へと導きます。25HCを結合したINSIGがPERKと直接結合して信号を伝達する可能性を調べましたが、そのような結合は認められず、INSIGがPERKをリン酸化・活性化する機構をさらに明らかにすることが今後の課題と言えます。動脈硬化、ウイルス感染、癌化等で細胞内酸化ステロールが上昇する状況下で細胞死をコントロールすることにより病態制御に結びつくことが期待されます。
発表雑誌
- 雑誌名
- The Journal of Biological Chemistry
- 論文タイトル
- Insulin-induced genes INSIG1 and INSIG2 mediate oxysterol-dependent activation of the PERK/eIF2α/ATF4 axis
- 著者
- Yuichi Watanabe, Takashi Sasaki, Shoko Miyoshi, Makoto Shimizu, Yoshio Yamauchi, and Ryuichiro Sato *(*責任著者)
- DOI番号
- 10.1016/j.jbc.2021.100989
- 論文URL
- https://www.sciencedirect.com/science/article/pii/S0021925821007912?via%3Dihub
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学研究室
教授 佐藤 隆一郎(さとう りゅういちろう)
Tel:03-5841-5136
Fax:03-5841-8029
E-mail:roysato<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
研究室URL:http://park.itc.u-tokyo.ac.jp/food-biochem/
用語解説
- 注1 ATF4 (Activating Transcription Factor 4)
翻訳開始因子eIF2α(eukaryotic Initiation Factor2α)がリン酸化されると、翻訳全般が停止されますが、転写因子ATF4の翻訳のみは特殊なシステムで促進され、ATF4タンパク質発現が上昇します。その結果、アミノ酸代謝関連遺伝子、アポトーシス関連遺伝子の転写が促進されます。今回の解析で、25HCによるATF4発現上昇は、アミノ酸代謝関連遺伝子よりアポトーシス関連遺伝子の発現を積極的に亢進することが観察されました。 - 注2 INSIG(Insulin Induced Gene)
6回膜貫通領域を持つ小胞体膜タンパク質。異なる遺伝子にコードされたINSIG1とINSIG2が存在するが、いずれも酸化コレステロール(特に25HCと27HC)を結合し、その結果安定化する性質を持ちます。コレステロール代謝を制御する転写因子SREBPの活性化抑制、HMG CoA還元酵素の分解など小胞体膜上で生じる制御機構に関与することが知られています。 - 注3 PERK(PKR-like Endoplasmic Reticulum Kinase)
小胞体ストレスが生じると3つの応答経路が活性化されますが、そのうちの一つが小胞体膜タンパク質PERKであり、リン酸化・活性化されます。この下流にeIF2αが位置します。eIF2αのリン酸化はPERK以外のキナーゼによっても行われますが、今回の解析で25HCはPERK-eIF2α-ATF4経路を活性化することが明らかとなりました。

