腸間膜リンパ節のエフェクターメモリーT細胞はIL-4環境を形成して食物アレルギー性小腸炎モデルマウスの骨量減少を引き起こす?
- 発表者
- 足立(中嶋)はるよ(東京大学大学院農学生命科学研究科附属食の安全研究センター 特任助教)
発表のポイント
- 食物アレルギー性小腸炎モデルマウスに併発する骨量減少の発症機構を、Th2型免疫応答の役割と、腸炎と骨量減少の関係を腸間膜リンパ節由来活性化T細胞の動向から証明した。
- 骨量減少は、卵白食の投与で腸炎と同じく活性化したTh2型免疫応答を引き金に生じること、腸炎の寛解後は腸間膜リンパ節が関わる急性期と質的に異なる応答により維持されることを示した。
- 難治性T細胞性消化管アレルギーでは骨量減少の併発を念頭におくこと、治療法として選択される免疫寛容の誘導では寛容状態の細胞の機能を評価する必要がある可能性を示した点に意義がある。
発表概要
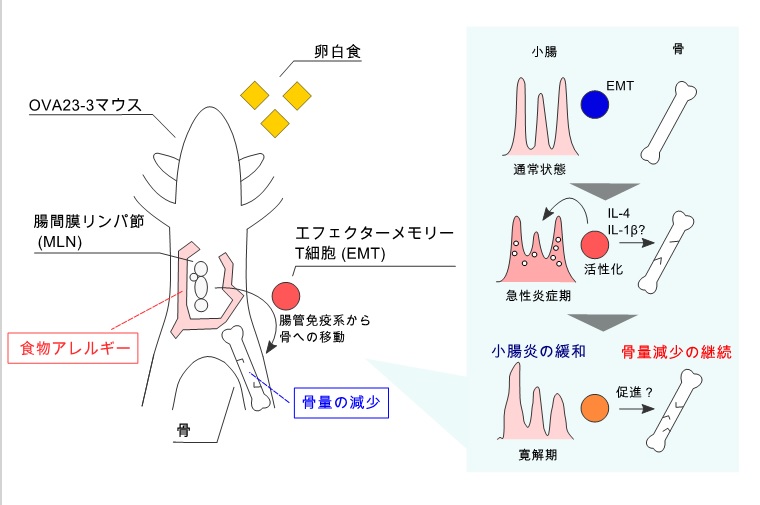
東京大学大学院農学生命科学研究科 足立(中嶋)はるよ特任助教らは、開発した食物アレルギー性小腸炎モデルマウスに併発する骨量減少の発症機構を解析し、腸間膜リンパ節(MLNs, 注1)で過剰に活性化したTh2型エフェクターメモリー(EM)T細胞(注2)の骨への移動が重要な役割を果たすことを示しました。腸炎はアレルゲンの経口投与に伴い急性期と慢性化した寛解期に分けられます。自己免疫疾患による骨量減少はTh17型の免疫応答により生じますが、本研究で新たに食物アレルギー性腸炎急性期ではTh2型で骨量減少が起こる事を示しました。さらに腸炎寛解期でも骨量減少が持続する要因を解析し、MLNsで誘導される寛解期のEMT細胞は破骨細胞(注3)による骨吸収を促すが、Th2型応答は大きく影響せず急性期と発症機構が異なることを示しました。MLNsで腸炎の寛解に関わるEMT細胞は骨量減少を促す可能性があります。食物アレルギーではアレルゲンの経口投与により耐性獲得を目指す治療がありますが(注4)、本研究はT細胞の強い活性化が関わる腸炎患者では、骨量減少を念頭にして治療で誘導されるT細胞の質的評価の必要性を示唆した点で社会的意義ある成果です。
発表内容
潰瘍性大腸炎やセリアック病などの炎症性の腸疾患(注5)は骨量減少を併発するとい言われ、活性化T細胞が疾患の発症に重要な役割を果たすことが報告されてきましたが、離れた器官で同時に起こる腸と骨の炎症の関係と発症機構は不明で、その解明には適切なモデルが必要でした。東京大学大学院農学生命科学研究科食の安全センターの足立(中嶋)特任助教らが開発した食物アレルギー性小腸炎モデルマウス・卵白アルブミン(OVA)特異的T細胞受容体遺伝子の組換えマウスであるOVA23-3マウスも、餌中のタンパク質がOVAを含む卵白からなる餌(卵白食)を投与すると小腸炎が誘導され骨量減少を併発します。そこでこのマウスを用い発症機構の検討を行いました。OVA23-3マウスは既存のモデルと異なり、原因(卵白食投与によるT細胞の活性化)と結果(腸炎の発症と寛解・骨量減少)の因果関係が明確であるため、発症機構の解明がしやすいからです。これまでの腸炎の研究から、1)腸炎は体重減少を伴い、OVAを認識する腸間膜リンパ節(MLNs)由来のT細胞が示すTh2型反応により誘導される、2)腸炎は急性期(卵白食投与9~10日)と慢性化した寛解期(投与後28日)に分けられ、寛解期には炎症を抑制する機能を持つ制御性T細胞(注6)が誘導され腸炎は軽快することが明らかになっています。一方で、骨量減少の発症機構の解明は、Th2型免疫応答と骨量減少の関係及び腸炎と骨量減少の関係を明らかにする必要がありました。特にこれまで炎症性腸疾患に伴う骨量減少はTh17型免疫応答により誘導され、Th2型はむしろ骨量減少を抑制すると考えられていました。
本研究では、腸炎の発症に必須であるMLNsとTh2型免疫応答の主体となるサイトカイン・インターロイキン4(IL-4)の機能に着目し、腸炎と骨量減少の発症の関係を証明するために、MLNsを切除する、又はIL-4に対する抗体(抗IL-4抗体)を投与し機能を止める手法を用いました。さらに両器官を移動し繋ぐ可能性のある細胞としてMLNs由来IL-4産生エフェクターメモリー(EM)T細胞を見出し、骨量減少を促進する細胞である破骨細胞による骨吸収に対するEMT細胞とIL-4の役割を解析しました。特にMLNsから骨髄へ移動するEMT細胞の解析には全身の免疫細胞を可視化できるKikume-Green Redタンパク質を発現するKikGRマウスを用いました。このマウスは標的臓器に紫色の光を照射すると、蛍光色素が緑から赤に変化するため赤色に標識された標的細胞の臓器間の移動が観察でき、その機能の解析が可能です。以下は明らかになった主な結果です。
- 1、腸炎の発症に必須であるMLNsが骨量減少においても重要な働きをする。
- 2、MLNsの切除により骨髄(BM)中のEMT細胞の数が有意に低下することから、EMT細胞はMLNsを中心とする腸炎と骨量減少を繋ぐ可能性がある。実際MLNsのEMT細胞は卵白食の摂取でBMへの移動が促進され、さらにEMT細胞を抑制する抗体の投与により骨量減少は有意に回復した。
- 3、MLNs中EMT細胞は破骨細胞の分化を促進することで骨吸収を促す可能性があるがIL-4はその促進には無関係でIL-4自体は破骨細胞の分化を抑制した。すなわちIL-4による破骨細胞の分化抑制を解除する分子の存在が示唆され、IL-1βがその機能を果たす可能性を証明した。
- 4、卵白食投与によりBMでもIL-4の過剰産生が観察された。抗IL-4抗体を炎症開始前から投与すると腸炎と骨量減少の両方が抑制され、IL-4を引き金に骨量減少が生じることを明らかにした。一方腸炎寛解期から抗IL-4抗体を投与した場合腸炎は回復が促進されたが、骨量減少は抑制されなかった。MLNs由来EMT細胞には制御性T細胞が含まれる。そこで寛解期では腸炎の寛解を誘導する制御性T細胞が骨量減少を悪化させる、もしくは腸炎由来の腸内細菌叢や生体内物質の変化が骨量減少の継続に影響する可能性が示唆された。
本研究はOVAの経口投与に伴い誘導されるIL-4産生(Th2型)T細胞の強い活性化に起因する腸炎モデルで、MLNs由来活性化EMT細胞がBMへ移動し形成するIL-4環境下で骨量減少が起こることを初めて明らかにし、腸炎寛解期における骨量は、腸炎由来のIL-4にその他の要因が加わって減少が継続される可能性を示しました。食物アレルギーの臨床ではアレルゲンを継続投与し寛容を獲得させる治療(経口免疫療法)が試され、制御性T細胞が寛解の指標として使われています。そこで、本研究の結果が制御性T細胞は寛解の指標として十分ではない可能性があり、その質的な評価の必要性を示唆した点は、特に社会的意義ある成果と考えます。今後は特に腸炎寛解期に骨量の減少が継続される別の要因の探索・制御性T細胞の質的評価を行い、炎症を制御する方法の開発を行う予定です。
【研究グループの構成(*責任著者)】
大町 愛子(雪印ミルクサイエンス研究所、雪印ビーンスターク(株)品質保証部)
山田 悟生(東京大学大学院農学生命科学研究科 大学院生:当時)
宇野 智(東京大学大学院農学生命科学研究科 大学院生:当時)
玉井 雅人(東京大学大学院農学生命科学研究科 大学院生)
曽我 皓平(東京大学大学院農学生命科学研究科 大学院生)
中村 翔太朗(東京大学大学院農学生命科学研究科 大学院生)
宇田川 信之(松本歯科大学歯学部生化学 教授)
中道 裕子(松本歯科大学総合歯科医学研究所 講師)
小出 雅則(松本歯科大学総合歯科医学研究所 准教授)
森田 如一(雪印ミルクサイエンス研究所)
高野 智弘(東京大学大学院農学生命科学研究科 大学院生:当時)
伊藤 匠(順天堂大学大学院医学研究科免疫病・がん先端治療学講座・アトピー疾患研究センター 博士研究員)
角田 茂(東京大学大学院農学生命科学研究科獣医学専攻 准教授)
森本 幾夫(順天堂大学大学院医学研究科免疫病・がん先端治療学講座 教授)
松岡 周二(順天堂大学大学院医学研究科免疫診断学講座 特任准教授)
岩倉 洋一郎(東京理科大学生命医科学研究所実験動物学研究部門 教授)
戸村 道夫(大阪大谷大学薬学部 教授)
清野 宏(カリフォルニア大学サンディエゴ校医学部教授/東京大学医科学研究所特任教授/千葉大学大学院医学薬学府特任教授)
八村 敏志(東京大学大学院農学生命科学研究科附属食の安全研究センター 准教授)
足立(中嶋)はるよ*(東京大学大学院農学生命科学研究科附属食の安全研究センター 特任助教)
発表雑誌
- 雑誌名
- Mucosal Immunology
- 論文タイトル
- Effector memory CD4+T cells in mesenteric lymph nodes mediate bone loss in food-allergic enteropathy model mice, creating IL-4 dominance
- 著者
- Aiko Ono-Ohmachi, Satoki Yamada, Satoru Uno, Masato Tamai, Kohei Soga, Shotaro Nakamura, Nobuyuki Udagawa, Yuko Nakamichi, Masanori Koide, Yoshikazu Morita, Tomohiro Takano, Takumi Itoh, Shigeru Kakuta, Chikao Morimoto, Shuji Matsuoka, Yoichiro Iwakura, Michio Tomura, Hiroshi Kiyono, Satoshi Hachimura, Haruyo Nakajima-Adachi*
- DOI番号
- 10.1038/s41385-021-00434-2
- 論文URL
- https://www.nature.com/articles/s41385-021-00434-2?proof=t
問い合わせ先
東京大学大学院農学生命科学研究科附属食の安全研究センター
特任助教 足立(中嶋)はるよ(あだち(なかじま)はるよ)
Tel:03-5841-5230
E-mail:haruyona<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 腸間膜リンパ節
腸管近傍に存在する腸管関連リンパ組織の一つ。腸管は常に外界に曝されている器官であるため、腸管の所属リンパ節である腸間膜リンパ節では腸管を経由して侵入する様々な非自己抗原に対して免疫応答を担う必要があり、樹状細胞やT細胞、B細胞など多様な免疫細胞がここに存在している。本研究で使われた食物アレルギー性小腸炎モデルマウスにおいては、IL-4産生などを伴う激しいTh2型炎症を引き起こす重要な器官である。 - 注2 エフェクターメモリーT細胞
メモリーT細胞の1種。T細胞は外来抗原に対する応答の仕方で4つの種類に分けられる。体内に侵入した抗原に、初めて応答する細胞をナイーブT細胞といい、この細胞が抗原刺激を受け取り活性化する。この活性化したT細胞をエフェクターT細胞と呼び、分化してさまざまな免疫応答に関わる。また、その一部は抗原除去後も死滅せず組織に残り続け、これをエフェクターメモリーT細胞と呼ぶ。この細胞がいることにより次回抗原侵入時に迅速に免疫応答が開始できる。さらに長期間の免疫応答を司るメモリーT細胞も存在する。エフェクターメモリーT細胞はその細胞表面の分子の発現パターンとしてCD62LlowCD44highCCR7-で分けられる。 - 注3 破骨細胞
生体において骨吸収を担う細胞である。生体が持つ骨は、新陳代謝が繰り返されることで構造が維持されている。古い骨は破壊され(骨吸収)、それを補うように新しい骨が形成(骨形成)されており、この仕組みを骨のリモデリングという。骨のリモデリングにおいて骨吸収を担う唯一の細胞が破骨細胞であり、骨形成を担う骨芽細胞とのバランスが健康な骨の維持に重要である。破骨細胞は、単球/マクロファージ系前駆細胞由来の多核巨細胞であり、酸やプロテアーゼを産生することによって骨基質を分解する。 - 注4 経口免疫療法
食物アレルギーの治療法であり、負荷試験により決められた量の原因食物を摂取することで、患者が食べられるようになることを目指す。自然経過では早期改善の見込みが低い食物アレルギーの症例に対する有効な治療法として期待されている。ただし、経過中に重度のアレルギー症状が発生する危険性も伴うため、医師の指導のもとで実施する必要がある。 - 注5 炎症性腸疾患
免疫系は本来、外部から侵入した有害な異物から自己を防衛するための仕組みである。しかし、何らかの原因によって免疫系に異常が生じると、自己の組織や細胞を異物と認識し、攻撃してしまう。その結果、臓器や関節などさまざまな部位に病気が発症する。炎症性の腸疾患は、このような免疫系の異常によって腸管に炎症が生じ、腹痛・下痢などの症状が発生する。しかし、免疫系の異常の原因は明らかではない。現在遺伝や環境、腸内細菌の異常などの要因が関わり、体内で異常が生じた免疫系の反応によって、腸の組織や細胞が攻撃され発症すると考えられている。自己免疫疾患と言われる場合もある。 - 注6 制御性T細胞
自己免疫疾患・アレルギー疾患などを引き起こす過剰な免疫応答を抑制する機能を持つT細胞。胸腺におけるT細胞の成熟過程で誘導される内在性の制御性T細胞と末梢血中のナイーブT細胞から腸管免疫系等で誘導される誘導性の制御性T細胞が存在する。発現する転写因子によっても分類されており、Foxp3をマスター転写因子として持つFoxp3+制御性T細胞や、Foxp3を発現せずIL-10を高産生するTr1などが存在する。制御性T細胞は、主にT細胞の増殖因子であるIL-2の消費や、TGF-β、IL-10などの抑制性サイトカインの産生などによってその抑制能力を発揮する。しかし、先の分類のように制御性T細胞はさまざまな基準で分類されており、種類ごとに機能が異なる可能性が示唆されている。