加熱調理で生じるオリゴ糖を分解する酵素を口腔内ビフィズス菌から発見
- 発表者
- 鹿島 騰真(東京大学大学院農学生命科学研究科応用生命工学専攻 大学院学生)
奥村 公喜(鹿児島大学農学部 学部学生;当時)
石渡 明弘(国立研究開発法人理化学研究所 専任研究員)
海江田 麿千加(鹿児島大学大学院農学研究科 大学院学生)
寺田 透(東京大学大学院農学生命科学研究科応用生命工学専攻 准教授)
荒川 孝俊(東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
山田 千早(東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
清水 謙多郎(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
田中 克典(国立研究開発法人理化学研究所 主任研究員)
北岡 本光(新潟大学農学部 教授)
伊藤 幸成(大阪大学理学研究科 特任教授)
藤田 清貴(鹿児島大学農学部 准教授)
伏信 進矢(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
発表のポイント
- 口腔内のビフィズス菌から新しい酵素「DFA Iシンターゼ/ヒドロラーゼ」を発見しました。
- DFA Iシンターゼ/ヒドロラーゼが加熱調理で生じる糖質「DFA I」の変換を触媒するしくみを詳しく明らかにしました。
- カラメルに含まれる主要なオリゴ糖であるDFA Iのビフィズス菌における分解メカニズムを初めて明らかにしたものであり、機能性オリゴ糖としてDFA Iの価値が見直されることも期待できます。
発表概要
砂糖を加熱調理して生じるカラメルには多種類のフルクトース含有糖が含まれていることが知られており、その一つにDFA Iというオリゴ糖があります。東京大学大学院農学生命科学研究科の鹿島騰真大学院学生と伏信進矢教授らのグループは、鹿児島大学、理化学研究所、新潟大学、大阪大学のグループと共同研究を行い、DFA Iを加水分解してイヌロビオースという糖にする酵素「DFA Iシンターゼ/ヒドロラーゼ」を発見し、その立体構造と反応機構を詳細に明らかにしました。さらに、本酵素はイヌロビオースからDFA Iを作る逆反応も約90%の効率で行うことが判明しました。本酵素はヒトの口腔内や腸内に生息するビフィズス菌から得られたこと、天然の植物由来のフルクトース含有糖にはこの酵素が切断する化学結合が見つかっていないことなどから、微生物が宿主であるヒトとの共生関係のもと、人類が火を使うようになった以降に、食料中の糖質を分解・代謝する酵素として出現したと推測しました。本研究は、カラメルに含まれる主要なオリゴ糖であるDFA Iのビフィズス菌における分解メカニズムを初めて明らかにしたものであり、機能性オリゴ糖としてDFAIの価値が見直されることも期待できます。
発表内容
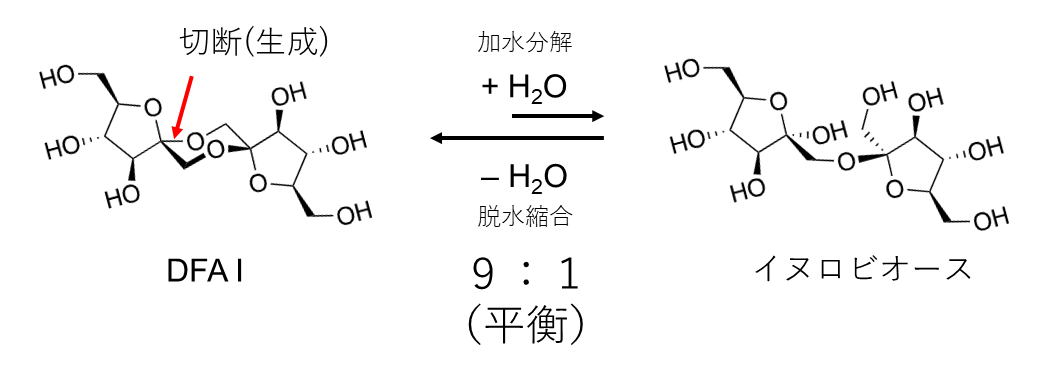
図1 DFA Iシンターゼ/ヒドロラーゼが触媒する反応
赤で示したα-フルクトフラノシド結合が加水分解される反応と、その逆の脱水縮合反応の両方を触媒する。試験管内でのこの反応はDFA Iが生成される方向に偏っている。微生物の細胞内においては、食品中に含まれるDFA Iを加水分解して、イヌロビオースがさらに代謝されて栄養源となる方向に反応が進んでいると考えられる。
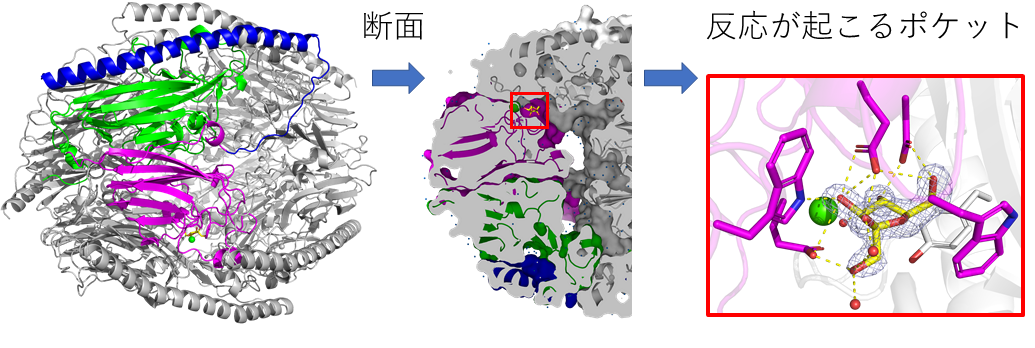
図2 DFA Iシンターゼ/ヒドロラーゼの立体構造
左:全体の構造。同じユニットが6個集まってできており、その一つに色をつけて表した。中:断面図。DFA Iおよびイヌロビオースが結合するポケットを赤で囲った。右:反応がおこるポケット。DFA Iの部分構造であるフルクトフラノースが結合している。
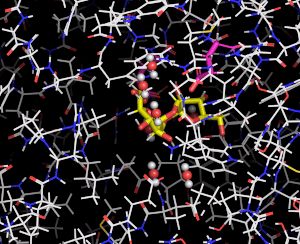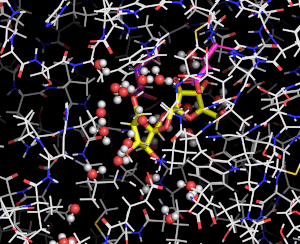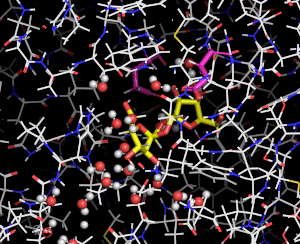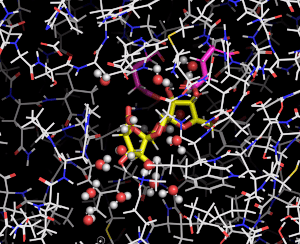
図3 DFA Iシンターゼ/ヒドロラーゼに結合したDFA Iの動き
分子動力学法により推定した結果をムービーで示している。DFA Iシンターゼ/ヒドロラーゼを細い線で、DFA Iは黄色の棒で表している。赤と白の球で表した水分子がDFA Iの周囲で共に動く様子がわかる。
砂糖はフルクトースを含む糖であり、加熱調理により脱水縮合(注1)が起こり、様々な化合物が生じます。その中に、2分子のフルクトースが脱水縮合したジフルクトースアンヒドリドI (DFA I)、ジフルクトースアンヒドリドIII (DFA III)などがあります。鹿児島大学の藤田清貴准教授らは、口腔内から単離されたビフィズス菌であるBifidobacterium dentiumから、DFA Iのα-フルクトフラノシド結合(注2)を加水分解(注1)してイヌロビオースという二糖を生じる酵素「DFA Iシンターゼ/ヒドロラーゼ」とその遺伝子を発見しました(図1)。東京大学大学院農学生命科学研究科の鹿島騰真大学院生、伏信進矢教授らのグループは、藤田清貴准教授、理化学研究所の石渡明弘専任研究員、新潟大学の北岡本光教授らと共同研究を行い、DFA Iシンターゼ/ヒドロラーゼの分子機構についてさらに研究を進めました。X線結晶構造解析法(注3)により本酵素の立体構造を明らかにして、DFA Iやイヌロビオースが結合するポケットのようすから、触媒反応がどのように起こるかを詳細に明らかにしました(図2)。さらに、応用生命工学専攻の寺田透准教授らによってDFA Iシンターゼ/ヒドロラーゼの分子動力学計算(注4)が行われ、DFA Iやイヌロビオースが酵素にどのように結合しているかという動的な状態が明らかになりました(図3)。
DFA Iシンターゼ/ヒドロラーゼは、約30年前にその存在は報告されていたものの、遺伝子の同定がなされておらず、全く研究が進んでいませんでした。今回の研究は「幻の酵素」を再発見し、その性質を詳しく明らかにしたという位置づけになります。本研究により、DFA Iシンターゼ/ヒドロラーゼはこれまでに知られている酵素とはアミノ酸配列(注5)が全く異なることが明らかになったため、糖質関連酵素の分類を行っているフランスのグループと協議を行った結果、新しい糖質加水分解酵素ファミリー(注6)であるGH172が新設され、そこに分類されることになりました。
これまで、β-フルクトフラノシド結合(注2)に作用する酵素は多数知られていましたが、α-フルクトフラノシド結合を加水分解する酵素とその遺伝子が同定されたのはDFAIII加水分解酵素に次いで二例目です。天然の植物が作るフルクトース含有糖は、砂糖の主成分であるスクロース(ショ糖)だけでなく、チコリやゴボウなどに多く含まれるイヌリン、麦類や大豆発酵産物などに多く含まれるレバン型フルクタンなど数多く知られていますが、いずれもβ-フルクトフラノシド結合のみでできており、α-フルクトフラノシド結合は見つかっていません。フルクトースやスクロース(砂糖)を加熱することにより脱水縮合が起こり、α-フルクトフラノシド結合を含むオリゴ糖が生じることは以前から知られていました。したがって、口腔内のビフィズス菌がα-フルクトフラノシド結合を分解する酵素を持つことは、宿主であるヒトが火を使うようになって以降に、共生関係のもとで分子進化が起こり、このような酵素が出現したことで、DFA Iを利用できるようになったと考えられます。
さらに、DFA Iシンターゼ/ヒドロラーゼの反応を試験管内で進行させると、最終的にDFA Iが9、イヌロビオースが1の割合で平衡に達することが分かりました(図1)。DFA Iはカラメルに含まれる主要なオリゴ糖です。また、DFA Iをイヌリンから大量調製する方法も既に確立されています。本研究は、ビフィズス菌における DFA Iの分解メカニズムを初めて明らかにしたものです。DFA IIIにはミネラル吸収促進作用などの機能性が知られており、DFAIにも同様の機能性が期待されます。このため、機能性オリゴ糖としてDFAIの価値が見直されることも期待できます。
発表雑誌
- 雑誌名
- The Journal of Biological Chemistry
- 論文タイトル
- Identification of a difructose dianhydride I synthase/hydrolase from oral bacterium establishes a novel glycoside hydrolase family
- 著者
- Toma Kashima, Kouki Okumura, Akihiro Ishiwata, Machika Kaieda, Tohru Terada, Takatoshi Arakawa, Chihaya Yamada, Kentaro Shimizu, Katsunori Tanaka, Motomitsu Kitaoka, Yukishige Ito, Kiyotaka Fujita*, and Shinya Fushinobu*
- DOI番号
- https://doi.org/10.1016/j.jbc.2021.101324
- 論文URL
- https://www.jbc.org/article/S0021-9258(21)01130-3/fulltext
問い合わせ先
東京大学大学院農学生命科学研究科応用生命工学専攻 酵素学研究室
教授 伏信 進矢(ふしのぶ しんや)
Tel:03-5841-5151
Fax:03-5841-5151
研究室URL:http://enzyme13.bt.a.u-tokyo.ac.jp/
用語解説
- 注1 脱水縮合と加水分解
2つの分子から、あるいは1つの分子内で水分子が脱離して新しい化学結合が生じる反応を脱水縮合と呼び、その逆に、水分子が付加して化学結合が切断される反応を加水分解と呼ぶ。DFA Iシンターゼ/ヒドロラーゼの逆反応では、イヌロビオースの分子内で脱離反応が起こり、環状化合物のDFA Iが生じる。 - 注2 α-フルクトフラノシド結合とβ-フルクトフラノシド結合
フルクトース同士が(二つのフルクトース分子が)結合するときに、2種類の結合の仕方(結合様式)がある。図1のDFA Iでは、左側の糖(フルクトフラノシド)がα-結合であり、右側の糖がβ-結合になっている。DFA Iシンターゼ/ヒドロラーゼによりα-結合が加水分解されたイヌロビオースはβ-結合のみで繋がっており、これは天然の多糖であるイヌリンにみられる部分構造である。 - 注3 X線結晶構造解析
酵素などのタンパク質の立体構造を明らかにするための最も一般的な解析方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることができる。 - 注4 分子動力学計算
多数の原子の動きを、ニュートンの運動方程式にもとづき、コンピュータで数値計算して求める手法。 - 注5 アミノ酸配列
タンパク質は20種類のアミノ酸が多数並んだポリペプチド鎖であり、その並び順をアミノ酸配列と呼ぶ。酵素(タンパク質)はアミノ酸配列の類似性により分類されることが多い。 - 注6 糖質加水分解酵素ファミリー
糖と糖の間の結合を、水を用いて切断する酵素のファミリー。英語ではGlycoside Hydrolaseと呼ばれ、”GH”の後に発見された順番に番号が付記される。このファミリーはフランスのグループが管理しているCAZyというデータベースで分類が行われており、非常に種類が多い。GH172はDFA Iシンターゼ/ヒドロラーゼの発見にともなって、それを分類するために新設されたファミリーである。

