進行性前立腺癌に対する新しい免疫療法の確立~制御性T細胞を制御する~
- 発表者
- 前田 真吾(東京大学大学院農学生命科学研究科 獣医学専攻 助教)
茂木 朋貴(東京大学大学院農学生命科学研究科 獣医学専攻 特任助教)
飯尾 亜樹(東京大学大学院農学生命科学研究科 獣医学専攻 博士課程3年)
梶 健二朗(東京大学大学院農学生命科学研究科 獣医学専攻 特任研究員)
米澤 智洋(東京大学大学院農学生命科学研究科 獣医学専攻 准教授)
桃井 康行(東京大学大学院農学生命科学研究科 獣医学専攻 教授)
発表のポイント
- 進行性前立腺癌(注1)を発症した犬において、制御性T細胞(Treg:注2)が腫瘍組織に浸潤するメカニズムを明らかにし、その阻害剤を用いたTreg浸潤抑制が有効な免疫療法となることを獣医師主導臨床試験により証明しました。
- ヒトの前立腺癌の一部の患者では犬に類似した遺伝子発現パターンを有しており、犬と同様のメカニズムによってTregの腫瘍内浸潤が引き起こされている可能性を見出しました。
- 本研究成果は、進行性前立腺癌に対する新しい治療法を提示するとともに、犬が進行性前立腺癌の有用な自然発症動物モデルであることを初めて実証しました。
発表概要
制御性T細胞(Treg)は炎症の収束や免疫寛容に関わる重要な免疫抑制細胞であり、腫瘍においては抗腫瘍免疫を抑制して患者の予後を悪化させることが知られています。Tregの腫瘍内浸潤を抑えることで抗腫瘍免疫を活性化する治療法がマウスモデルで提唱され、ヒトでもいくつかの腫瘍において有効性に関する症例報告がありますが、進行性前立腺癌における有効性の情報はありませんでした。
東京大学大学院農学生命科学研究科の前田真吾助教らの研究グループは、犬の進行性前立腺癌症例を用いて、①腫瘍組織へのTreg浸潤が予後を悪化させること、②Tregの腫瘍内浸潤にはケモカイン(注3)のひとつであるCCL17(注4)とその受容体であるCCR4が関与していること、③CCR4阻害剤の投与が前立腺癌に対して有効であることを明らかにしました。さらにヒトの前立腺癌患者においても同様のメカニズムでTreg浸潤が引き起こされている可能性を見出しました。
本成果により、CCR4を標的とした「制御性T細胞を制御する治療戦略」が進行性前立腺癌に対する新しい免疫療法となる可能性が示されました。また犬が進行性前立腺癌の自然発症動物モデルとして有用であることを示した初めての研究成果です。
発表内容
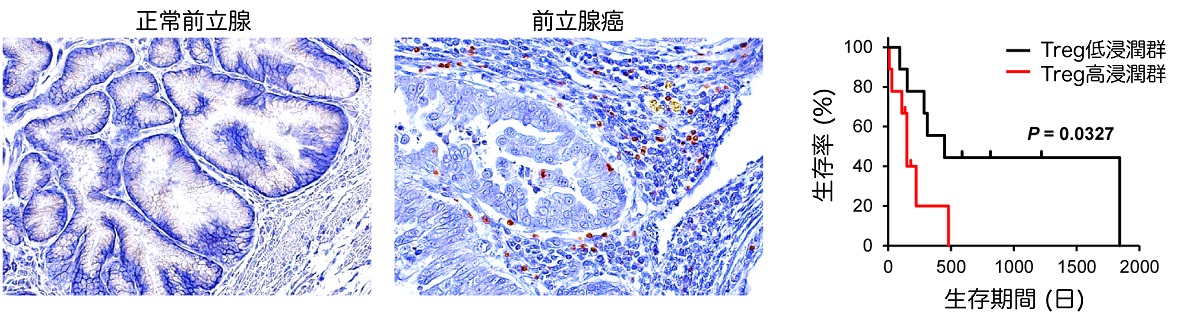
図1 犬の進行性前立腺癌におけるTreg浸潤
左:正常な前立腺組織ではTregがほとんど観察されないのに対して、前立腺癌組織では多数のTreg(茶色く染色されている細胞)が認められた。
右:犬の前立腺癌症例において、Treg高浸潤群の方が低浸潤群に比べて生存期間が短縮していた。
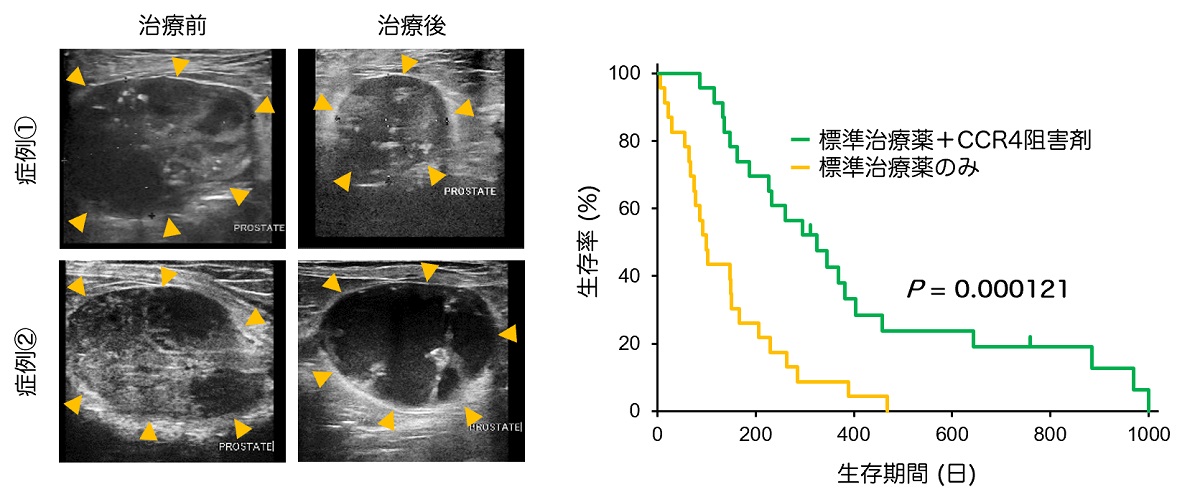
図2 進行性前立腺癌の犬に対するCCR4阻害剤の獣医師主導臨床試験
左:治療前の前立腺腫瘤(矢頭)と比較して、CCR4阻害剤の投与後では腫瘤サイズの顕著な縮小(症例①)や腫瘤内部の融解(症例②)が認められた。
右:標準治療を実施したコントロール群(黄色)と比べてCCR4阻害剤を併用投与した群(緑色)では生存期間が約3倍に延長した。
前立腺癌は男性に発生する最も頻度の高い悪性腫瘍であり、全世界での新規患者数は毎年約120万人、前立腺癌による死亡者数は毎年約36万人にものぼると推定されています。ヒトの前立腺癌は一般的に男性ホルモンを抑制するホルモン療法によく反応し、多くの患者の予後は良好です。しかし、約10%の患者はホルモン療法が反応しない去勢抵抗性前立腺癌へと進行します。さらに腫瘍細胞が前立腺以外の臓器に広がり、リンパ節や肺、骨に転移してしまう進行性前立腺癌では生存期間中央値が15ヵ月程度と予後不良であり、有効な治療法の開発が切望されています。しかし去勢抵抗性や転移能、抗腫瘍免疫を有する進行性前立腺癌のマウスモデルは非常に限られており、進行性前立腺癌の研究は他の固形癌と比べて遅れているのが現状でした。
伴侶動物である犬は実験動物のマウスと異なり、遺伝的・環境的・免疫学的に多様性を持っています。さらに犬は一定の割合で前立腺癌を自然発症する唯一の動物であり、その臨床症状や進行・転移様式、ホルモン療法に反応しない去勢抵抗性などの特徴はヒトの進行性前立腺癌と類似していることが知られています。そのため、犬の前立腺癌がヒトの進行性前立腺癌の有用な動物モデルとなるのではないかと考えられてきました。
東京大学大学院農学生命科学研究科の前田真吾助教の研究グループは、進行性前立腺癌を自然発症した犬を用いてTregの腫瘍内浸潤メカニズムを明らかにし、その分子メカニズムに基づいた治療法の有効性を評価しました。はじめに犬の進行性前立腺癌の腫瘍組織を調べたところ、約半数の症例でTregが顕著に認められました。一方、正常な前立腺組織ではTregはほとんど認められませんでした(図1・左)。前立腺癌の犬をTreg高浸潤群と低浸潤群に分類し、各群の予後を比較したところ、Treg高浸潤群の方が低浸潤群よりも生存期間が短いことがわかりました(図1・右)。つぎにTreg浸潤メカニズムを調べるために、次世代シーケンサーを用いて正常前立腺と進行性前立腺癌の遺伝子発現を網羅的に解析しました。その結果、前立腺癌ではCCL17と呼ばれるケモカインの発現が正常組織の約700倍に増加していました。さらに前立腺癌組織に存在するTregが CCL17の受容体であるCCR4を高発現していることを確認しました。そこで進行性前立腺癌の犬を2つのグループに分け、1つには標準治療として用いられる薬剤を単独で投与し、もう1つのグループには標準治療薬に加えてCCR4阻害剤を投与する獣医師主導臨床試験を実施しました。その結果、CCR4阻害剤を投与した症例では血液中および腫瘍組織中のTregが減少し、腫瘤体積の縮小や腫瘤内部の融解が認められました(図2・左)。CCR4阻害剤を投与した群と標準治療を実施したコントロール群で生存期間を比較したところ、コントロール群と比べてCCR4阻害剤投与群では生存期間が約3倍に延長しました(図2・右)。
続いて犬とヒトの前立腺癌の遺伝子発現パターンを解析したところ、ヒト前立腺癌の一部の患者では犬に類似した遺伝子発現パターンを有していることがわかりました。ヒトの前立腺癌患者の腫瘍組織においても犬と同様に多数のTregが観察され、腫瘍組織内に浸潤しているTregはCCR4を高発現していました。さらにヒトの前立腺癌において、CCL17を高発現している患者ではそうでない患者と比べて生存期間が短いことがわかりました。以上の結果より、ヒト前立腺癌の一部の患者では犬と共通のメカニズムでTregの腫瘍内浸潤が引き起こされていることが示されました。今後、ヒトの進行性前立腺癌に対するCCR4阻害剤の臨床試験を実施することで、新たな免疫療法の誕生につながることが期待されます。
本研究は、科研費(課題番号:JP16H06208、JP19H00968、JP20K15675)およびアニコムキャピタル研究助成(EVOLVE)の支援により実施されました。
発表雑誌
- 雑誌名
- Journal for ImmunoTherapy of Cancer
- 論文タイトル
- Anti-CCR4 treatment depletes regulatory T cells and leads to clinical activity in a canine model of advanced prostate cancer
- 著者
- Shingo Maeda*, Tomoki Motegi, Aki Iio, Kenjiro Kaji, Yuko Goto-Koshino, Shotaro Eto, Namiko Ikeda, Takayuki Nakagawa, Ryohei Nishimura, Tomohiro Yonezawa, Yasuyuki Momoi(*責任著者)
- DOI番号
- 10.1136/jitc-2021-003731
- 論文URL
- http://dx.doi.org/10.1136/jitc-2021-003731
問い合わせ先
東京大学大学院農学生命科学研究科 獣医学専攻 獣医臨床病理学研究室
助教 前田 真吾(まえだ しんご)
Tel:03-5841-3096
E-mail:amaeda<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
研究室HP:https://www.maedalab.com/
用語解説
- 注1 進行性前立腺癌
前立腺癌の中でも腫瘍細胞が前立腺以外の臓器に広がり、リンパ節や肺、骨などに転移するもの。腫瘍細胞が前立腺の内部にとどまる限局性前立腺癌と比べて極めて予後不良である。 - 注2 制御性T細胞(regulatory T-cell:Treg)
免疫応答を抑制するリンパ球(免疫細胞の一種)。炎症の収束や免疫寛容に重要な役割を果たすことが知られている。 - 注3 ケモカイン
サイトカインの一種で、細胞の移動や遊走を促進する蛋白質。 - 注4 CCL17
細胞を遊走させるケモカインの一種で、TARCとも呼ばれる。CCR4と呼ばれる受容体のリガンドとして機能する。

