加水分解酵素とキャリアタンパク質による新規なペプチド合成機構の解明
- 発表者
- 川合 誠司 (東京大学大学院農学生命科学研究科 応用生命工学専攻 博士課程1年、2021年度研究科長賞)
勝山 陽平 (東京大学大学院農学生命科学研究科 応用生命工学専攻 准教授)
大西 康夫 (東京大学大学院農学生命科学研究科 応用生命工学専攻 教授)
発表のポイント
- 放線菌が生産するペプチド性化合物 (アラゾペプチン) の生合成において、加水分解酵素 (AzpM) が キャリアタンパク質(AzpF) に結合したアミノ酸の縮合を触媒する反応機構を明らかにしました。
- AzpMの触媒機構は、全く異なるファミリーの酵素 (一部のI型NRPSのTEドメイン) が有するペプチド二量体化の反応機構と類似性が示唆されました。
- 抗がん活性を持つアミノ酸として有名なアザセリンを含む、新規のジペプチドやトリペプチドを複数創出しました。
発表概要
アラゾペプチンは、2分子の6-diazo-5-oxo-L-norleucine (DON) と1分子のL-アラニンからなるトリペプチドで、東京大学大学院農学生命科学研究科・応用生命工学専攻のグループにより、昨年その生合成経路の全容が解明されました。しかしながら、キャリアタンパク質 (AzpF) に結合したDON (DON-AzpF) が、2分子のDONからなるDON-DONに変換される反応を担う、AzpM (加水分解酵素) の反応機構は未解明でした。本研究において、同グループはDONのアナログ分子であるアザセリンを用い、組換えタンパク質の試験管内酵素反応実験を行いました。その結果、AzpMは2分子のDON-AzpFを縮合することでDON-DONを合成することが明らかになりました。また、この実験の過程で、アザセリンを含む、新規なペプチド化合物の創出に複数成功しました。本研究成果は、ペプチド系医薬品の開発に役立つと期待されます。
※査読の結果、本研究論文は、Very Important Paper (VIP) に選出され、ハイライトされました。
発表内容
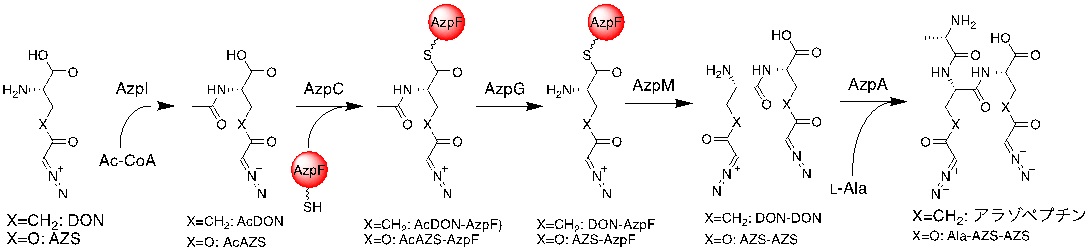
図1:以前の研究で明らかになった、アラゾペプチンのペプチド組み立て経路と、アザセリン (AZS) を基質にした際のペプチド合成反応。 (拡大画像↗)
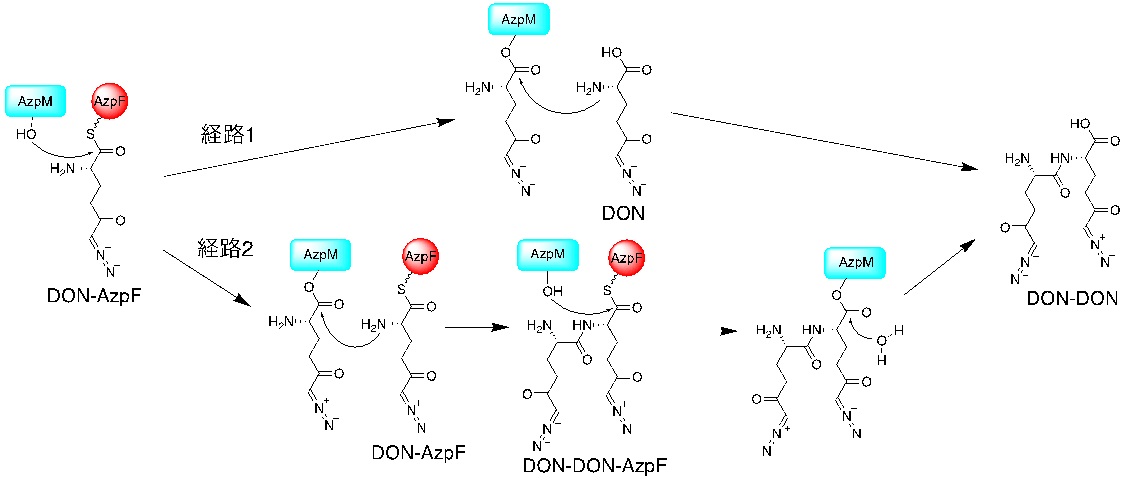
図2:AzpMの予想反応機構。本研究から、経路2が正しいことが示されました。(拡大画像↗)
微生物をはじめとする生物が生産する天然物は、古くから医薬品や染料などの原料として利用されてきました。中でも、ペプチド系化合物は、強い生理活性を示すことが多いため、注目を集めています。特に、リボソームによる翻訳を介さず生合成される非リボソームペプチド (NRP) は、構成アミノ酸の種類に制限がなく、多様な構造、生物活性を有します。一般的なNRPの生合成は、巨大なマルチドメイン酵素であるI型非リボソームペプチド合成酵素 (I型NRPS, 注1) が担います。その一方で、各修飾ドメインが独立したII型NRPSの存在も近年少しずつ明らかになっています。
昨年、東京大学大学院農学生命科学研究科・応用生命工学専攻のグループは、2分子の6-diazo-5-oxo-L-norleucine (DON) と1分子のL-アラニンからなるトリペプチドであるアラゾペプチンの、放線菌 (注2) による生合成経路の全容を解明しました(1)。アラゾペプチンのペプチド結合のうちの一つが、II型NRPSにより合成されることが、組換えタンパク質による試験管内再構築により示されました。本システムでは、まず、AzpK, AzpJ, AzpLによりL-リシンと亜硝酸から生合成されたDONのアミノ基が、AzpIによりアセチル化され、N-acetyl-DON (AcDON) となります。その後、AzpCがAcDONを活性化し、キャリアタンパク質であるAzpFにチオエステルを介して結合し、AcDON-AzpFが形成されます。AcDON-AzpFはAzpGにより脱アセチル化され、DON-AzpFになります。そして、加水分解酵素であるAzpMがDON-AzpFを用いて、2分子のDONからなるジペプチド (DON-DON) を合成します。最後に、AzpAがDON-DONとL-アラニンを縮合してアラゾペプチンが出来上がります。このように、ペプチド組み立て経路の全容が明らかになりましたが、本システムの中で最も興味深い、AzpMによるペプチド結合形成の触媒機構は明らかになっていませんでした。
AzpMによるペプチド合成の反応機構は2通り考えられました。1つ目は、AzpMがDON-AzpFとDONの縮合を触媒することで、DONをAzpFから切り離し、DON-DONを作る経路です (経路1)。2つ目の経路では、まずAzpMが2分子のDON-AzpF間の縮合を触媒し、DON-DON-AzpFを合成します。ついで、AzpMがDON-DON-AzpFからDON-DONを加水分解により切り離す経路です (経路2)。以前の研究では、組換えタンパク質を用いた試験管内反応の際の反応液中から遊離したDONを取り除くことができなかったため、どちらの経路が正しいか同定することができませんでした。
そこで同グループは、DONと構造がよく似たアナログ分子であるアザセリン (AZS) に着目しました。なお、AZSも放線菌が生産する天然物ですが、その生合成機構はわかっていません。まず、アラゾペプチンのペプチド組み立てシステムがAZSを認識し、ジペプチドであるAZS-AZSや、トリペプチドであるAla-AZS-AZSなどを合成できることを、組換えタンパク質を用いた試験管内反応により確認しました。
次に、AzpIによる反応と限外濾過により、AcDONとAcAZSを調製しました。なお、本反応は100%の効率で進むわけではないので、サンプル中に未反応のDONやAZSが存在しています。経路1が正しい場合は、DONとAcAZSを基質としてAzpC, AzpF, AzpG, AzpMと反応させた際にDONとAZSからなるヘテロペプチドが合成されると考えられます。逆に、経路2が正しい場合には、上述の条件ではAZS-AZSのみ合成され、AcDONとAcAZSを反応させた際にのみDONとAZSからなるヘテロペプチドが合成されると考えられます。なぜならば、アセチル化されたDONおよびAZSのみがキャリアタンパク質AzpFにロードされることがわかっているからです。同グループはこれらの予想を元に、組換えタンパク質を用いた試験管内反応により、DONとAZSからなるヘテロペプチドが合成される条件を精査しました。その結果、AcDONとAcAZSを反応させた際にのみDONとAZSからなるヘテロペプチドが合成されることが判明し、AzpMの反応は経路2が正しいことが強く示唆されました。さらに同グループは、経路2の反応中間体であるDON-DON-AzpFとAZS-AZS-AzpFの直接的な検出にも成功し、上記の仮説の補強にも成功しました。
本研究により、加水分解酵素であるAzpMが2分子のDON-AzpFを用いてDON-DONを合成することが示されました。この反応は、一部のI型NRPSのチオエステラーゼ (TE) ドメインが有する、ペプチドの二量体化とマクロ環化反応に類似していますが、これらのTEドメインとAzpMは異なるPfamファミリー (注 3) に属するとともに、II型NRPSシステムでの同様の反応の発見例はこれまでありませんでした。また、AzpMの反応機構の同定の過程で、AZSを組み込んだ複数の新規ペプチドの合成に成功したことも重要です。今回の発見は、将来的には医薬品の原料になりうる様々なペプチド系化合物の創出に繋がると期待されます。
【参考文献】
(1)Seiji Kawai et al., (2021). Complete biosynthetic pathway of alazopeptin, a tripeptide consisting of two molecules of 6-diazo-5-oxo-L-norleucine and one molecule of alanine, Angew. Chem. Int. Ed., 60, 10319-10325.
発表雑誌
- 雑誌名
- ChemBioChem
- 論文タイトル
- The α/β hydrolase AzpM catalyzes dipeptide synthesis in alazopeptin biosynthesis using two molecules of carrier protein-tethered amino acid
- 著者
- Seiji Kawai, Yohei Katsuyama, and Yasuo Ohnishi
- DOI番号
- 10.1002/cbic.202100700
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 醗酵学研究室
准教授 勝山 陽平
Tel:03-5841-5124
Fax:03-5841-8021
研究室URL:https://www.hakko.bt.a.u-tokyo.ac.jp
E-mail:aykatsuhko<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 非リボソームペプチド合成酵素 (NRPS)
生物の中でタンパク質の合成を担うリボソームを用いずに、ペプチド系天然物合成を担う酵素で、アミノ酸の認識と活性化を担うアデニル化 (A) ドメイン、活性化されたアミノ酸とチオエステルを介して結合するキャリアタンパク質 (CP) ドメイン、2つのCPドメイン間のペプチド結合形成を触媒する縮合 (C) ドメインなどの複数のドメインを有する、巨大なタンパク質のことを指します。Aドメインは、非タンパク質性アミノ酸も認識すると同時に、修飾酵素のバリエーションも豊富であることから、NRPSにより合成されるペプチドは多様な構造を示します。なお、このようなNRPSをI型NRPSと呼称し、それぞれのドメインが独立、あるいは2つ程度からなるNRPSのことを、近年II型NRPSと呼称する例が見られるようになっています。 - 注2 放線菌
主に土壌中に生息する、グラム陽性細菌の一群のことを指します。原核生物としては高度な形態分化を示す他、ゲノムサイズも比較的大きいことが知られています。また、抗生物質や抗がん剤として用いられている多くの医薬品の生産を担うことから、産業上も極めて有用な細菌群でもあります。 - 注3 Pfamファミリー
Pfamとは欧州バイオインフォマティクス研究所 (EBI) の提供するタンパク質ファミリー (分類) のデータベースであり、タンパク質の機能予測にとって重要です。主に隠れマルコフモデルを用いてタンパク質を分類しています。

