A型インフルエンザウイルスの受容体特異性を機能的に評価する新奇の方法を確立
- 発表者
- 神木 春彦(東京大学大学院農学生命科学研究科 獣医学専攻 博士課程院生:当時)
村上 晋(東京大学大学院農学生命科学研究科 獣医学専攻 准教授)
松郷 宙倫(東京大学大学院農学生命科学研究科 獣医学専攻 特任助教:当時)
石田 大歩(東京大学大学院農学生命科学研究科 獣医学専攻 博士課程院生:当時)
片山 美沙(東京大学大学院農学生命科学研究科 獣医学専攻 博士課程院生)
関根 渉(東京大学大学院農学生命科学研究科 獣医学専攻 博士課程院生)
上間亜希子(東京大学大学院農学生命科学研究科 獣医学専攻 特任助教)
堀本 泰介(東京大学大学院農学生命科学研究科 獣医学専攻 教授)
発表のポイント
- A型インフルエンザウイルスのヒト型受容体や鳥型受容体を欠損する細胞を樹立しました。
- これらの細胞における様々なウイルス株の増殖性から、これまで検出できなかった受容体特異性がみつかりました。
- 鳥ウイルスのヒト型受容体結合性の獲得に必要な変異を同定しました。
- これらの欠損細胞は、インフルエンザウイルスの受容体特異性の機能的評価、さらに鳥ウイルスのヒトへの感染性獲得メカニズムを解析するための強力なツールになります。
発表概要
A型インフルエンザウイルスのシアル酸受容体には、ヒトウイルスが結合するヒト型受容体と鳥ウイルスが結合する鳥型受容体があります。今回、これら受容体の片方あるいは両方を欠損する細胞を樹立しました。欠損細胞における様々なヒトや鳥ウイルス株の増殖性を調べたところ、シアル酸との物理的な結合性を測定する従来の方法では検出できない受容体特異性の存在が明らかになりました。また、両方の受容体を欠損する細胞でも、ウイルスが増殖することがわかり、シアル酸以外の受容体の存在が示唆されました。欠損細胞における増殖性を指標とする解析により、鳥ウイルスがヒト型受容体への生物学的な結合性を獲得するのに重要な変異を同定しました。樹立したシアル酸欠損細胞は、インフルエンザウイルスの受容体特異性の機能的評価、非シアル酸受容体の探索、さらに鳥ウイルスのヒトへの馴化メカニズムの解明に貢献する強力なツールになります。
発表内容
A型インフルエンザウイルスの受容体は細胞表面のシアル酸です。ヒトウイルスはガラクトースにα2-6結合したシアル酸(ヒト型受容体)を、鳥ウイルスはα2-3結合したシアル酸(鳥型受容体)を認識し細胞に感染します。この受容体分子の違いから、鳥ウイルスが直接ヒトに感染することはまずありません。しかし、ヒトの肺深部には鳥型受容体をもつ細胞がわずかながら存在するため、鳥インフルエンザウイルスに感染した家禽(鶏など)と濃厚接触した場合には、偶発的にヒトに感染することがあります。感染すると過剰な免疫反応が惹起され、重篤な呼吸不全や全身性の臓器障害が起きることで、死亡する例も少なくありません。過去のH5N1やH7N9鳥インフルエンザウイルス(注1)のヒトへの感染事例はその代表になります。ただし、ウイルス自体はヒトからヒトへ容易に伝播する性状をもたなかったため、パンデミックには発展しませんでした。しかし、その性状、つまりヒト型受容体に容易に結合しヒトの上部気道細胞で効率よく増殖する性状を獲得すると、鳥ウイルスを起源とする新たなインフルエンザパンデミック(注2)が発生する恐れがあります。
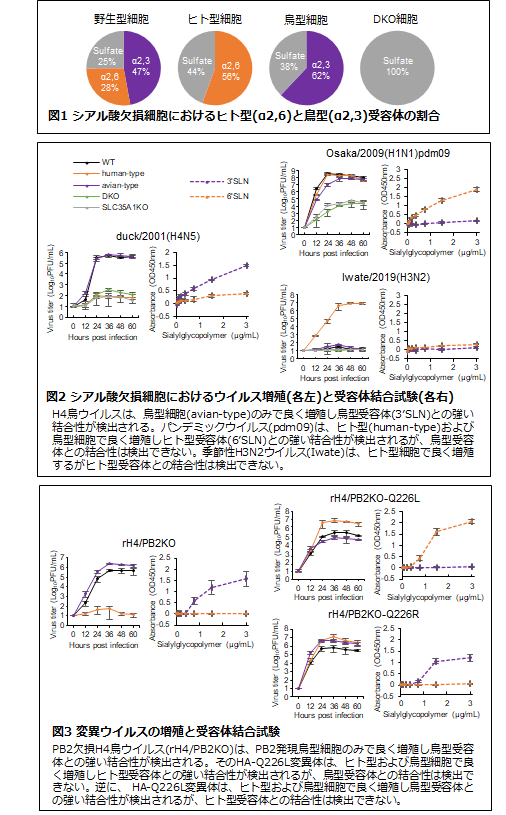
パンデミックの発生を防ぐためには、鳥ウイルスなどを対象とするサーベイランスにより、ヒトへの感染潜在性をもつウイルスを摘発することが重要です。特に、ヒト型受容体への結合性評価は必須であり、これまでにいくつかの方法(固相糖鎖結合試験や糖鎖アレイ法など(注3))が開発され用いられています。しかし、これらの方法は、ウイルスとシアル酸との物理的結合の検出にとどまるため、それが実際のウイルス感染性にどう反映されるのかは評価できません。今回私たちは、ウイルスの受容体特異性を機能的に(生物学的に)評価する方法の確立を考え、まず、多くのウイルス株が効率よく増殖する犬腎臓由来MDCK細胞を用い、α2-3およびα2-6結合するシアル酸を付加する酵素群(ST3Gal1~6およびST6Gal1, 2)、あるいはCMP-シアル酸輸送体(SLC35A1)(注4)をCRISPR/Cas9法(注5)によりノックアウトしたヒト型受容体欠損細胞(鳥型細胞と呼ぶ)、鳥型受容体欠損細胞(ヒト型細胞)、両受容体欠損細胞(DKO細胞)を樹立しました(図1)。これらの欠損細胞に様々な鳥やヒトウイルスを感染させ、増殖性から各ウイルスの受容体特異性を評価しました。H4、H6、H8鳥ウイルス株、およびヒト由来PR8(H1N1)実験室株は、ヒト型細胞ではほとんど増殖しませんでした(代表例を図2に示す)。また、ヒトパンデミックH1N1pdm2009株は鳥型細胞では増殖が遅くなりました(図2)。これらのウイルス株は、特定の受容体を優先的に用いることを示しています。一方、ヒト季節性H1N1ウイルス)やAichi(H3N2:香港型)実験室株は、ヒト型細胞や鳥型細胞において野生型細胞と同程度に増殖しましたが、DKO細胞ではほとんど増殖しませんでした。したがって、これらの株は両タイプの受容体を用いることがわかりました。並行して、各ウイルス株の物理的なシアル酸結合性を従来の方法により測定したところ、検出された結合性は欠損細胞におけるウイルス増殖性とは必ずしも相関しないことがわかりました(図2)。本研究により、ヒトと鳥ウイルス間にみられる感染性の違いは、生物学的な受容体特異性に依存することが確認され、また、株や継代歴に応じてその特異性が変化することが示されました。一方、従来法ではウイルスの機能的な受容体特異性を正確に評価できないことがわかりました。
鳥インフルエンザウイルスがヒトに馴化するためには、ヒト型受容体への結合力を上げる変異を獲得する必要があります。そのような変異の検出が、ウイルスサーベイランスの目標になります。そこで、鳥ウイルスのヒト型受容体への生物学的な結合性を獲得する変異の同定を試みました。H4N5鳥ウイルス由来のHAとNA(注6)をもつウイルスを、実験室WSN株をバックグラウンドとしてリバースジェネティクス法(注7)により作出しました。バイオセイフティーの観点から、PB2遺伝子(注8)をGFPレポーター遺伝子に置き換えた非増殖型ウイルス(通常細胞では増殖しない)を用いました。同ウイルスを、PB2を発現させたヒト型細胞で継代したところ、増殖性が上昇した馴化ウイルスが得られ、おもにHA1-Q226L/Rの変異がみつかりました。HA1-Q226Lはヒト型受容体への結合性を上げることが従来の受容体結合試験でも検出されましたが、HA1-Q226Rについては検出できませんでした(図3)。つまり、HA1-Q226Rの受容体特異性における生物学的な重要性は、今回の実験系を用いることで初めて明らかになりました。
本研究で樹立したシアル酸欠損細胞は、インフルエンザウイルスの受容体特異性の機能的評価や、鳥ウイルスのヒトへの馴化メカニズムの解明に資する強力なツールとして、パンデミックの発生メカニズムの解明と抑止へ大きく貢献するものと期待されます。 本研究は、JSPS科学研究費補助金(挑戦的萌芽:17K19319; 基盤A:18H03971)の助成により実施されました。
発表雑誌
- 雑誌名
- Journal of Virology
- 論文タイトル
- Influenza A Virus Agnostic Receptor Tropism Revealed Using a Novel Biological System with Terminal Sialic Acid Knockout Cells.
- 著者
- Haruhiko Kamiki*, Shin Murakami*, Takashi Nishikaze, Takahiro Hiono, Manabu Igarashi, Yuki Furuse, Hiromichi Matsugo, Hiroho Ishida, Misa Katayama, Wataru Sekine, Yasushi Muraki, Masateru Takahashi, Akiko Takenaka-Uema, Taisuke Horimoto
*Contributed equally
神木春彦1、村上晋1、西風隆司2、日尾野隆大3、五十嵐学4、古瀬祐気5、松郷宙倫1、石田大歩1、片山美沙1、関根渉1、村木靖6、高橋雅輝7、上間亜希子1、堀本泰介1
所属1.東京大学大学院農学生命科学研究科獣医学専攻、2.島津製作所田中耕一記念質量分析研究所、3.産業技術総合研究所:当時、 4.北海道大学人獣共通感染症国際共同研究所、5.京都大学白眉センター:当時、6.岩手医科大学医学部、7.岩手県環境保健研究センター - DOI番号
- 10.1128/jvi.00416-22
- 論文URL
- https://journals.asm.org/doi/10.1128/jvi.00416-22
問い合わせ先
東京大学大学院農学生命科学研究科 獣医学専攻 獣医微生物学研究室
准教授 村上 晋(むらかみ しん)
Tel:03-5841-5398
Fax:03-5841-8184
E-mail:shin-murakami<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
教授 堀本 泰介(ほりもと たいすけ)
E-mail:taihorimoto<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 H5N1・H7N9鳥インフルエンザ
H5N1をはじめとするH5亜型の高病原性鳥インフルエンザウイルスは、ここ20年以上進化しながら世界中に蔓延し、養鶏産業に甚大な被害を及ぼしている。この間、ヒトへの偶発的な感染による約500名の死者が確認されている。一方、2013年に発生したH7N9低病原性(一部高病原性)鳥インフルエンザの流行では、中国で600名を超える死者を出したが現在は終息している。 - 注2 インフルエンザパンデミック
A型インフルエンザウイルスの世界的大流行のこと。過去にはスペイン風邪(H1N1ウイルス)、アジア風邪(H2N2)、香港風邪(H3N2)、2019年の豚由来パンデミック(H1N1pdm)がある。ヒトは鳥ウイルスに対する防御抗体をもたないため、鳥ウイルスが効率よくヒト集団に感染・伝播する変異を獲得すると、新たなパンデミックが発生する危惧がある。 - 注3 固相糖鎖結合試験や糖鎖アレイ法
ウイルスの各シアル酸分子への物理的な結合性を測定する方法。マイクロプレートやアレイプレート上に特定あるいは網羅的な人工合成あるいは生体から調整した糖鎖を固相化し、それらに対してウイルスの結合性を検出する方法。 - 注4 CMP-シアル酸輸送体(SLC35A1)
SLC35A1は、ゴルジ装置への糖ヌクレオチド(CMP-シアル酸)の輸送を担うタンパク質。CMP-シアル酸はシアル酸供与体であるため、SLC35A1遺伝子をノックアウトすると糖鎖へのシアル酸付加が起きなくなる。 - 注5 CRISPR/Cas9法
細胞の任意のゲノムDNA部位を切断することで遺伝子を編集する方法。導入されたガイドRNA(gRNA)がゲノム上の標的配列に結合しCas9ヌクレアーゼがDNAを切断する。修復過程のエラーにより欠失や挿入などの変異が起き遺伝子が破壊(ノックアウト)される。 - 注6 HAとNA
A型インフルエンザウイルスのエンベロープ糖タンパク質には、赤血球凝集素(hemagglutinin: HA)とノイラミニダーゼ(neuraminidase: NA)がある。HAは、ウイルスの細胞への感染に必要なシアル酸受容体への結合とエンドソーム膜との膜融合活性を担う。一方、細胞表面のシアル酸をNAが消化することでウイルスが細胞から遊離する。 - 注7 リバースジェネティクス法
A型インフルエンザウイルスのゲノムRNA分節(PB2, PB1, PA, HA, NP, NA, M, NS分節)を合成する8種類とゲノムの転写・複製を担うタンパク質(PB2, PB1, PA, NP)を発現する4種類の計12種類のプラスミドを、同時に培養細胞に導入することでウイルスを人工的に作出する方法。任意の変異ウイルスを作出できる。 - 注8 PB2遺伝子
A型インフルエンザウイルスのRNAポリメラーゼ複合体を構成するサブユニットの一つであるPB2タンパク質をコードするウイルス増殖に必須の遺伝子。