天然有機化合物の生合成における新規アミノ基導入酵素の発見
- 発表者
- 野口 智弘(東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程3年)
磯貝 章太(東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程3年:当時)
寺田 透(東京大学大学院農学生命科学研究科応用生命工学専攻 准教授)
西山 真(東京大学アグロバイオテクノロジー研究センター 教授)
葛山 智久(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
発表のポイント
- 放線菌が生産する抗酸化物質、ナフテルピンの生合成遺伝子の一つであるアミノ基転移酵素遺伝子nphEを特定し、それがコードする酵素NphEが触媒する反応を明らかにしました。
- NphEは、ナフテルピンの生合成中間体であるモンペインに対して、グルタミン酸由来のアミノ基を転移するだけでなく酸化も触媒することで、8-アミノフラビオリンに変換するアミノ基転移酵素であることを示し、その反応機構の詳細を提唱しました。
- 新しいアミノ基転移酵素NphEの発見は、天然化合物の構造多様性を創出するための戦略の理解だけではなく、多様な化合物を人工的に創りだすための酵素ツールボックスの拡張にも繋がります。
発表概要
微生物の一種である放線菌の中には、抗腫瘍、抗菌、抗酸化活性などを示すメロテルペノイドと呼ばれる天然化合物を生産するものがいます。メロテルペノイドの多様な生物活性の基となる構造の多様性は、よく似た構造のポリケタイド骨格とテルペノイド骨格が融合し、さらにテルペノイド部分が環状化することで生み出されます。
東京大学大学院農学生命科学研究科応用生命工学専攻の共同研究グループは、メロテルペノイドの一種であるナフテルピンの特徴的な構造がどのように生合成されるのかを研究しています。同グループは、これまでに、ナフテルピンを作るのに必要な遺伝子の大部分を特定していました。しかしながら、それらの遺伝子の中に、ナフテルピンの構造には含まれないアミノ基の付加に関与すると考えられる生合成酵素遺伝子が含まれており、本当に、この遺伝子(nphE)がナフテルピンの生合成に関与するのか不明なままでした。今回、同グループは、nphEがナフテルピンの生合成に欠かせない遺伝子であり、ナフテルピンの生合成中間体に対して一過的に”隠された”アミノ基を付加するとともに酸化も触媒するアミノ基転移酵素遺伝子であることを示しました。この発見は、メロテルペノイドの構造多様性を創出するための自然界の巧みな生合成戦略の理解に繋がります。
発表内容
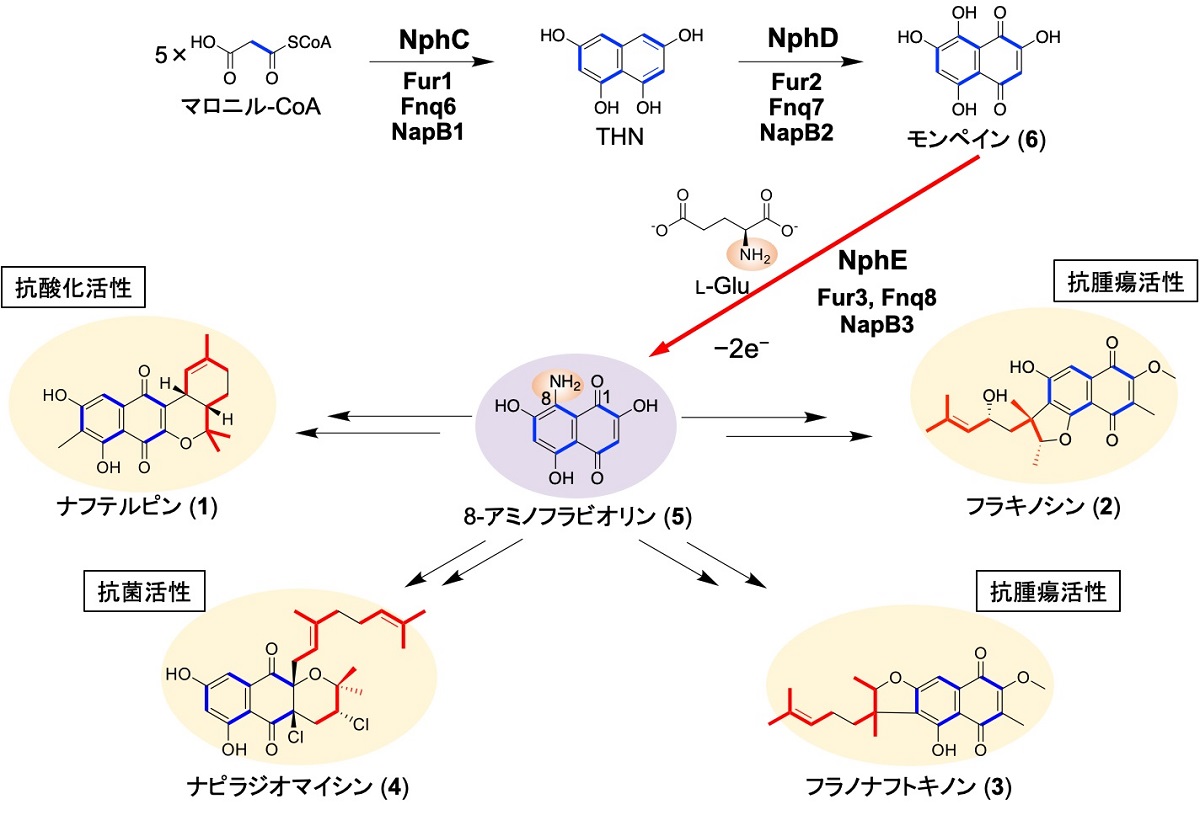
図1:放線菌の生産するメロテルペノイドの構造とその生合成経路(参考文献1–5).
Nph, ナフテルピン生合成酵素; Fur, フラキノシン生合成酵素; Fnq, フラノナフトキノン生合成酵素; NapB, ナピラジオマイシン生合成酵素 (拡大画像↗)
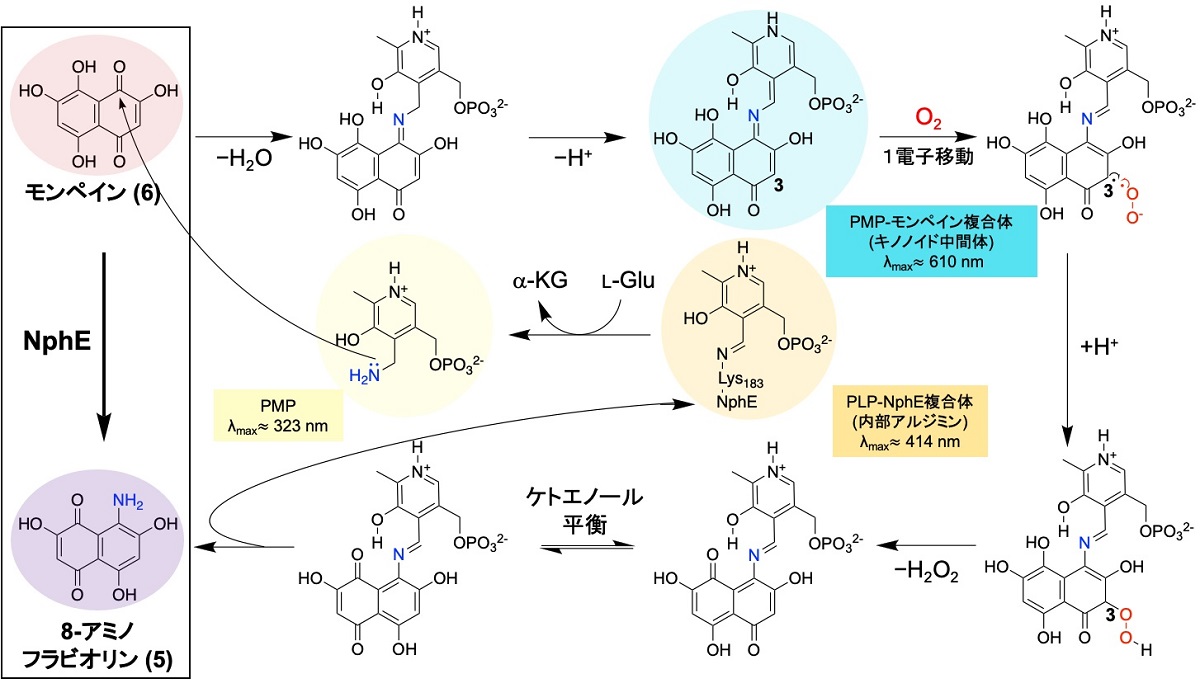
図2:今回提唱したNphEの反応機構.
Lys, L-リジン; α-KG, α-ケトグルタル酸; L-Glu, L-グルタミン酸; PLP, ピリドキサールリン酸; PMP, ピリドキサミンリン酸(拡大画像↗)
放線菌が生産するメロテルペノイドとして、Streptomyces sp. CL190の生産するナフテルピン(1)、Streptomyces sp. KO-3988の生産するフラキノシン(2)をはじめとしてフラノナフトキノン(3)やナピラジオマイシン(4)が知られています。メロテルペノイドは、よく似た構造のポリケタイド骨格(青色)とテルペノイド骨格(赤色)が融合し、さらにテルペノイド部分が環状化することで構造多様性が生み出されているという特徴があります(図 1)。この構造多様性のため、抗腫瘍、抗菌、抗酸化活性などの多様な生物活性を示します。これらメロテルペノイドに共通の生合成中間体として8-アミノフラビオリン(5)が同定されていました。しかし、ナフテルピン等いずれのメロテルペノイドにも8位のアミノ基が存在せず、アミノ基は水素原子に置換されます。さらに、この普遍的なアミノ基導入および除去反応はこれまでに知られている機構とは大きく異なるため、反応機構や生理的意義を含め興味深い研究対象でありました(図1)。そこで、東京大学大学院農学生命科学研究科応用生命工学専攻の共同研究グループは、ナフテルピンを生産する放線菌、Streptomyces sp. CL190株を用いて、このアミノ基導入機構の解明に取り組みました。
これまでモンペイン(6)から8-アミノフラビオリン(5)への変換は、L-グルタミン酸(L-Glu)をアミノ基供与体、6を受容体としたアミノ基転移であり、補酵素であるピリドキサールリン酸(PLP)(注1)依存性のアミノ基転移酵素NphEやそのホモログが反応を担うことが示唆されていました。しかし、6から5への変換過程においては二電子の酸化も必要であり、NphEの反応機構については不明なままでした。NphEによる二電子が移動する酸化は、酸素分子によって達成されると推測されたため、大腸菌で発現させたNphE組換え酵素を用いた試験管内反応によって証明することにしました。
今回、分光光度計や酸素電極を用いることで、図2の様なNphEの反応機構を明らかにすることができました。まずNphE活性中心のリジン残基に結合したPLPによって形成されたPLP-NphE複合体(極大吸収λmax ≈ 414 nm)とL-Gluとのアミノ基交換によってPMP(極大吸収λmax ≈ 323 nm)が形成されます。次にPMPのアミノ基が6の1位のカルボニル炭素に求核攻撃をして、脱水を伴ってイミンへと変化し、続く脱プロトン化によって非常に長い共役系を有するキノノイド中間体であるPMP-モンペイン複合体(極大吸収λmax ≈ 610 nm)を生成します。さらにPMP-モンペイン複合体のモンペイン部分の3位の炭素から酸素への一電子移動と再結合によってペルオキシ中間体(R-OOH)が発生し、過酸化水素の脱離とケトエノール互変異性、リジン残基による5の切り出しが起こり、NphEの内部アルジミンが再生することで反応サイクルが回転していきます。
さらにNphEのAlphafold v2.0(注2)による予測構造とPMP-モンペインとの複合体のシミュレーションを行った結果からも、PMP-モンペイン複合体認識に関わるアミノ酸残基や、モンペイン部分の3位まで通じる酸素の通り道が示され、今回のNphEの反応機構を支持する結果を得ることができました。
本研究では、ナフテルピンの生合成機構を詳細に解析することで、最終産物のナフテルピンには存在しない”隠された”アミノ基の「酸化的な」導入という生体内での官能基変換戦略の重要性の一端を明らかにすることができました。今後は、導入されたアミノ基の除去機構を解明することで、メロテルペノイドの構造多様性を創出するための”隠された”アミノ基導入と除去いう自然界の巧みな生合成戦略の理解に繋げたいと考えています。
本研究は、文部科学省科学研究費補助金新学術領域研究(研究領域提案型)「生合成リデザイン」(16H06453)の支援を受けて行われました。野口智弘は、特別研究員(DC1)として日本学術振興会の支援(19J22569)を受けました。
発表雑誌
- 雑誌名
- Journal of the American Chemical Society 144: 5435–5440 (2022).
- 論文タイトル
- Cryptic Oxidative Transamination of Hydroxynaphthoquinone in Natural Product Biosynthesis
- 著者
- Tomohiro Noguchi (野口 智弘)1、Shota Isogai (磯貝 章太)1、Tohru Terada (寺田 透)1、Makoto Nishiyama (西山 真)2、Tomohisa Kuzuyama (葛山 智久)1*
1Graduate School of Agricultural and Life Sciences, The University of Tokyo
2Agro-Biotechnology Research Center, The University of Tokyo - DOI番号
- 10.1021/jacs.1c13074
- 論文URL
- http://pubs.acs.org/doi/abs/10.1021/jacs.1c13074
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 分子育種学研究室
教授 葛山 智久(くずやま ともひさ)
Tel/Fax:03-5841-3080
E-mail:utkuz<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
研究室URL:https://webpark2107.sakura.ne.jp/index.html
研究室Twitter:@Kuzuyama_Lab
用語解説
- 注1 ピリドキサールリン酸(PLP)
ピリドキサールリン酸(PLP)は様々な酵素の補欠分子族の1つで、ビタミンB6の活性型である。PLP依存性酵素はアミノ基転移反応をはじめとして、脱炭酸、エピメリ化など多様な反応を触媒し、全酵素の約4 %を占める巨大な酵素グループであると推定されている。酵素反応において、PLPは多くの場合、電子シンクとしての役割を果たし、キノノイド中間体の安定性が反応に重要である。 - 注2 Alphafold v2.0
DeepMind社が開発した高精度なタンパク質構造予測プログラム。
(参考文献1) Shin-ya, K., et al. Isolation and structural elucidation of an antioxidative agent, naphterpin. J. Antibiot. 1990, 43, 444-447.
(参考文献2) Komiyama, K., et al. Novel antibiotics, furaquinocins A and B. Taxonomy, fermentation, isolation and physico-chemical and biological characteristics. J. Antibiot. 1990, 43, 247-252.
(参考文献3) Ishibashi, M., et al. Novel antibiotics, furaquinocins C, D, E, F, G and H. J. Antibiot. 1991, 44, 390-395.
(参考文献4)Shiomi, K., et al. Structures of new antibiotics napyradiomycins. J. Antibiot. 1986, 39, 494-501.
(参考文献5)Sedmera, P., et al. New Furanonaphthoquinone from Streptomyces cinnamonensis. J. Nat. Prod. 1991, 54, 870-872.

