寄生虫に感染したマクロファージが多核化する機構
- 発表者
- 洪 婧(東京大学 大学院農学生命科学研究科 応用動物科学専攻 博士課程学生)
三條場 千寿(東京大学 大学院農学生命科学研究科 応用動物科学専攻 助教)
藤井 渉(東京大学 大学院農学生命科学研究科 獣医学専攻 助教)
山岸 潤也(北海道大学 人獣共通感染症国際共同研究所 准教授)
後藤 康之(東京大学 大学院農学生命科学研究科 応用動物科学専攻 教授)
発表のポイント
- 寄生虫の一種であるリーシュマニアは、マクロファージを宿主細胞として生存・増殖します。
- リーシュマニア感染がもたらす宿主細胞の性質変化の一つが多核化であり、多核化したマクロファージは正常な赤血球を貪食するようになります。
- この感染誘導性マクロファージ多核化に関与する因子としてATP6V0D2を同定しました。
発表概要
寄生虫性疾患である内臓型リーシュマニア症(VL:注1)の患者では、骨髄やリンパ節のマクロファージ(Mφ:注2)によって自己の赤血球が貪食される現象が高頻度で見られます。東京大学大学院農学生命科学研究科・応用免疫学研究室の研究グループは、「リーシュマニア原虫が宿主細胞を自身の生存に好適な環境に改変する」ことについて研究を行っており、これまでに様々な分子機構を明らかにしてきました。今回、Mφの性質変化の一つである多核化に焦点をあて研究を行い、原虫感染誘導性の多核化にV-ATPaseの構成成分として知られるATP6V0D2(注3)が関与することを明らかにしました。Mφの多核化は病態形成にも関与することから、この分子を標的とすることで原虫の増殖と症状の両方を抑えるといった内臓型リーシュマニア症の新たな治療法につながることが期待できます。
発表内容
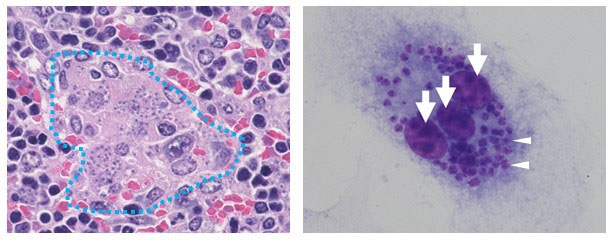
図1:リーシュマニア原虫感染によるMφの多核化。左:Ld感染マウス脾臓で観察されるMGC。右:In vitroでMφに原虫(矢頭)を感染させることで多核化(矢印)したMφ。 (拡大画像↗)
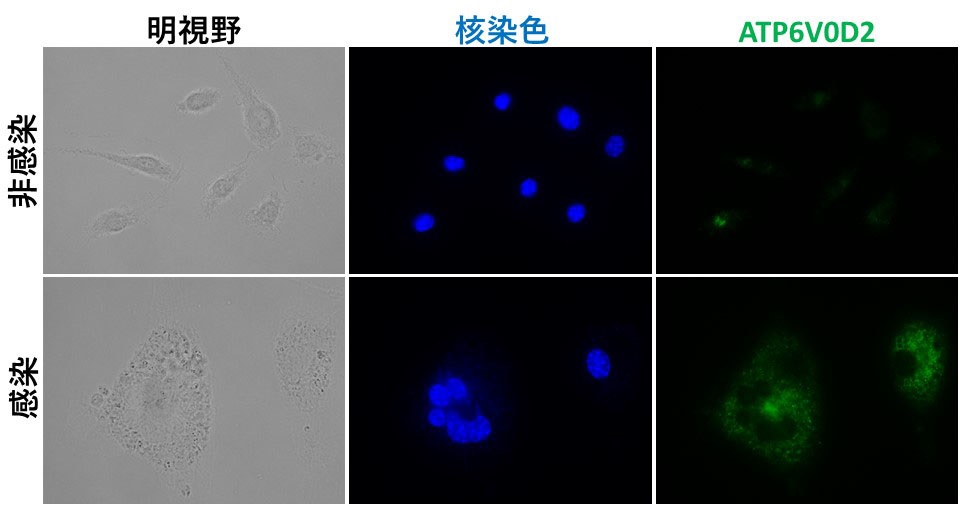
図2:Ld感染によるATP6V0D2の発現上昇。非感染Mφ(上段)と比較して、感染により多核化したMφ(下段)はATPV0D2の高い発現が見られる。(拡大画像↗)
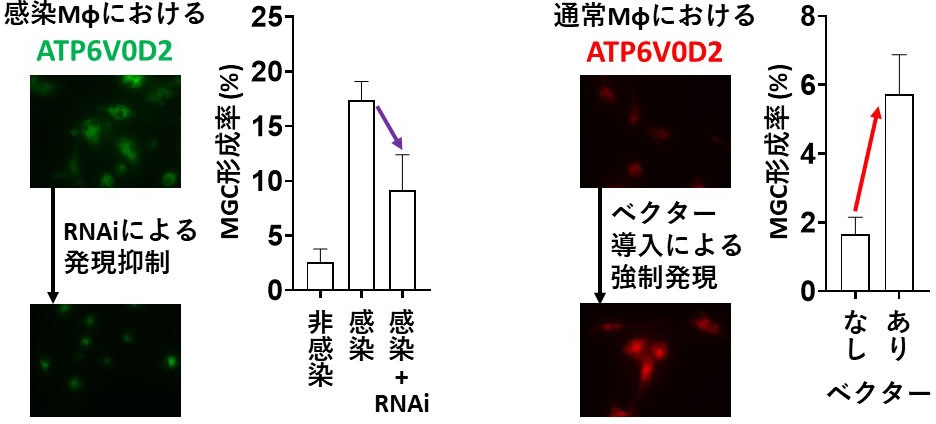
図3:Ld感染によるATP6V0D2依存的なMφの多核化。左:Ld感染により上昇したATP6V0D2をRNAiにより発現抑制すると、MGCの形成率が低下した。右:通常のMφにプラスミドベクターを用いてATP6V0D2の発現を誘導すると、MGCの形成率が上昇した。(拡大画像↗)
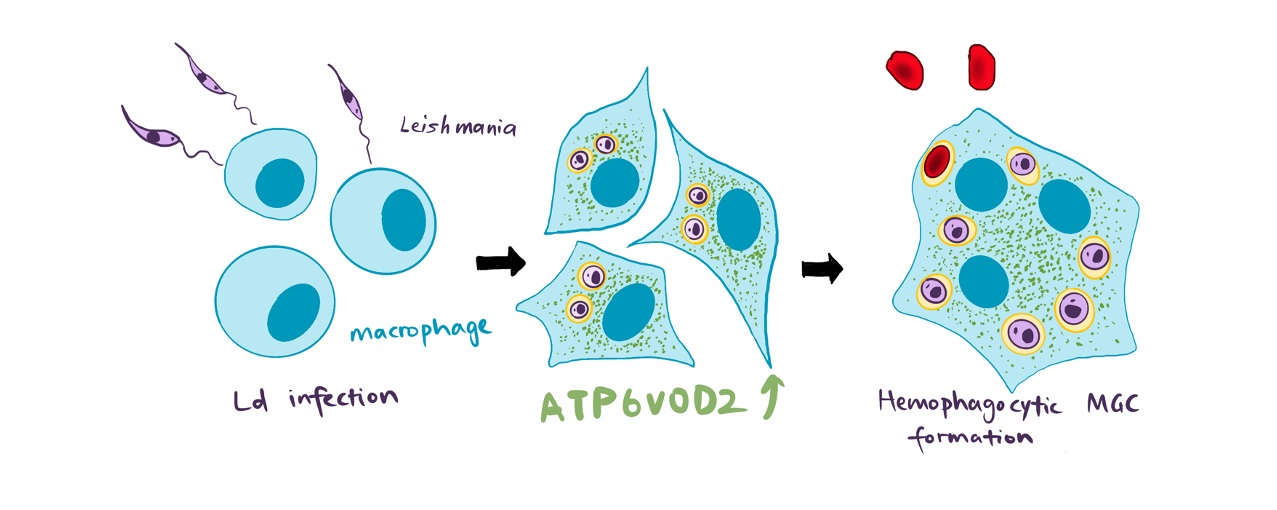
図4:リーシュマニア原虫感染がもたらすATP6V0D2依存的なMφ多核化の概念図(拡大画像↗)
赤血球は通常であれば造血と破壊のバランスが取れていますが、通常より高頻度で赤血球の破壊が起こり、結果として貧血がおきたり重症化して死に至る場合があります。赤血球破壊のメカニズムの一つとして脾臓における赤血球貪食の異常亢進があり、VLの典型的な症状である貧血においても赤血球貪食の亢進が関与していると考えられています。後藤教授らの研究グループでは、リーシュマニア原虫Leishmania donovani(Ld)の感染により貧血を呈するマウスモデルを作成して、その病態形成機序の研究を行っています。これまでに、Ld感染により貧血を呈するマウスの脾臓では赤血球の貪食が亢進すること(Morimoto et al., 2016, PLoS NTDs)や、原虫が感染したMφにおいて自己認識に関わる分子であるSIRPαの発現が低下すること(Morimoto et al., 2019, PLoS NTDs)を明らかにしてきました。これら原虫感染によるMφの性質変化は原虫の生存に有利にはたらくとともに、病態形成にも関与するため、創薬のターゲットとしても魅力的です。しかしながら、感染により誘導されるMφの性質変化に関わる分子機構には不明な点が多く残っています。
本研究では、Mφの性質変化のうち、多核化に焦点を当てて研究を行いました。感染などによって炎症反応がおこっている組織では、複数のMφの融合体であると考えられる多核巨細胞(multinucleated giant cell: MGC)がしばしば見られます。VLにおいても、脾臓において多数のMGCが観察され、また赤血球を貪食する細胞は主としてMGCであることが分かっています(図1左)。そこで、まずin vitroにおいてMφにLdを感染させたところ、感染単独でMφの多核化を誘導できることが明らかになりました(図1右)。サイトカインなどによってもMφの多核化は誘導できますが、そのMGCの性質には違いがあり、Ld感染で誘導されるMGCは特に赤血球の貪食能が高いことが分かりました。これらの結果は、原虫感染がユニークな機構を介して病的なMGCの形成を誘導することを示唆しています。
次に、その分子機構を明らかにするため、ATP6V0D2の発現を解析しました。この分子は、破骨細胞の多核化に関与することやLd感染によりマウス脾臓で発現が最も上昇する遺伝子の一つであることから、感染マウスで見られるMGCの形成にも関与することが考えられました。そこで、in vitroにおいてLd感染Mφを解析したところ、①感染MφでATP6V0D2の発現が上昇すること(図2)、②ATP6V0D2の発現上昇は他のV-ATPase構成成分の発現上昇を伴わないこと、③感染MφにおいてATP6V0D2の発現抑制をするとMGCの形成率が低下すること(図3左)、④非感染MφでATP6V0D2を強制発現するとMGCの形成率が上昇すること(図3右)が明らかとなりました。これらのことは、原虫感染したMφにおいて、ATP6V0D2はV-ATPaseの構成成分としてではなく独立した機能によってMφの多核化を誘導することを示しています。
本研究を通して、リーシュマニア原虫感染が宿主細胞であるMφにもたらす病的な性質変化のメカニズムの一端を明らかにすることができました。Mφによる赤血球貪食は細胞内にいる原虫の生存に有利な環境をもたらしており、本研究の成果は原虫の増殖と症状の両方を抑えるといった内臓型リーシュマニア症の新たな治療法につながることが期待できます。また、MGCの形成はVLに限らず他の疾患でも見られることから、病的Mφが関与する疾患の理解につながることも期待できます
本研究は日本学術振興会、グローバルヘルス技術振興基金、北海道大学人獣共通感染症国際共同研究所一般共同研究による支援を受けて実施されました。
発表雑誌
- 雑誌名
- Frontiers in Cellular and Infection Microbiology(オンライン版の場合:2022年9月23日)
- 論文タイトル
- Leishmania infection-induced multinucleated giant cell formation via up-regulation of ATP6V0D2 expression
- 著者
- Jing Hong, Chizu Sanjoba, Wataru Fujii, Junya Yamagishi, Yasuyuki Goto
- DOI番号
- 10.3389/fcimb.2022.953785
- 論文URL
- https://www.frontiersin.org/articles/10.3389/fcimb.2022.953785
問い合わせ先
東京大学大学院農学生命科学研究科 応用動物科学専攻 応用免疫学研究室
教授 後藤 康之(ごとう やすゆき)
Tel:03-5841-5196
E-mail:aygoto<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 内臓型リーシュマニア症
リーシュマニア原虫の感染によって引き起こされる寄生虫性疾患であるリーシュマニア症のうち最も重篤なタイプであり、インド、ブラジル、エチオピアなどの熱帯地域で年間5~9万人の発症者をもたらしています(世界保健機構、2022年)。典型的な症状として発熱、肝脾腫、体重減少、貧血などが挙げられ、治療しないと90%以上が死に至るとされています。 - 注2 マクロファージ(Mφ)
白血球の一つで、病原体など異物を貪食・消化する働きを持つ免疫細胞であり、大食細胞ともよばれます。死細胞やウィルス感染細胞に発現する分子を認識して貪食を行う一方で、自分と同じMHCやCD47などを有する自己細胞は貪食しません。リーシュマニア原虫が哺乳類宿主の体内に侵入した際には、原虫の宿主細胞としても機能します。 - 注3 ATP6V0D2
ATP6V0D2はプロトンの輸送に関与するV-ATPaseの構成成分の一つとして知られています。プロトンの輸送はリソソームの酸性化に関与しており、Mφによる異物の消化にも関与すると考えられています。ただし、Ld感染によるATP6V0D2の発現上昇は他のV-ATPaseの構成成分の発現変化と連動しないことや、ATP6V0D2の局在がリソソームと重ならないことから、まだ明らかになっていないATP6V0D2の機能が本研究を通して見えてきました。

