リジン長鎖アシル化による新規転写制御機構の発見 〜転写因子TEADを標的とした新たながん治療法開発に期待〜
発表のポイント
- 転写因子TEADの新しい翻訳後修飾としてリジン長鎖アシル化を発見しました。
- TEADのリジン長鎖アシル化は、近接したシステイン残基を介した分子内転移によって引き起こることを明らかにしました。
- リジン長鎖アシル化は転写共役因子であるYAPおよびTAZとの結合活性を増強することにより、TEADの転写活性に寄与することを明らかにしました。
- リジン長鎖アシル化を阻害する化合物はTEADの活性を抑制することが期待でき、抗がん剤として有望です。
発表概要
Hippo経路下で働く転写因子TEADは器官形成に重要な一方で、その異常な活性化は腫瘍形成を招くことが知られています。そのため、TEADはがん治療の分子標的として注目されています。今回、東京薬科大学 生命科学部 細胞情報科学研究室の則次恒太研究員、伊藤昭博教授(国立研究開発法人理化学研究所 客員主管研究員)、国立研究開発法人理化学研究所の吉田稔グループディレクター(東京大学 特別教授)、堂前直ユニットリーダー、日本大学の小川健司教授らの研究グループは、TEADの新規翻訳後修飾としてリジン長鎖アシル化を発見し、この修飾がTEADの転写活性に重要な役割を果たすことを明らかにしました。この研究は、リジン長鎖アシル化による転写制御機構を世界に先駆けて明らかにしたものであり、TEADを標的としたがん治療法への応用が期待できます。
本研究は、オンライン科学雑誌『Cell Reports』(4月14日付:日本時間4月15日)に掲載されました。
発表内容
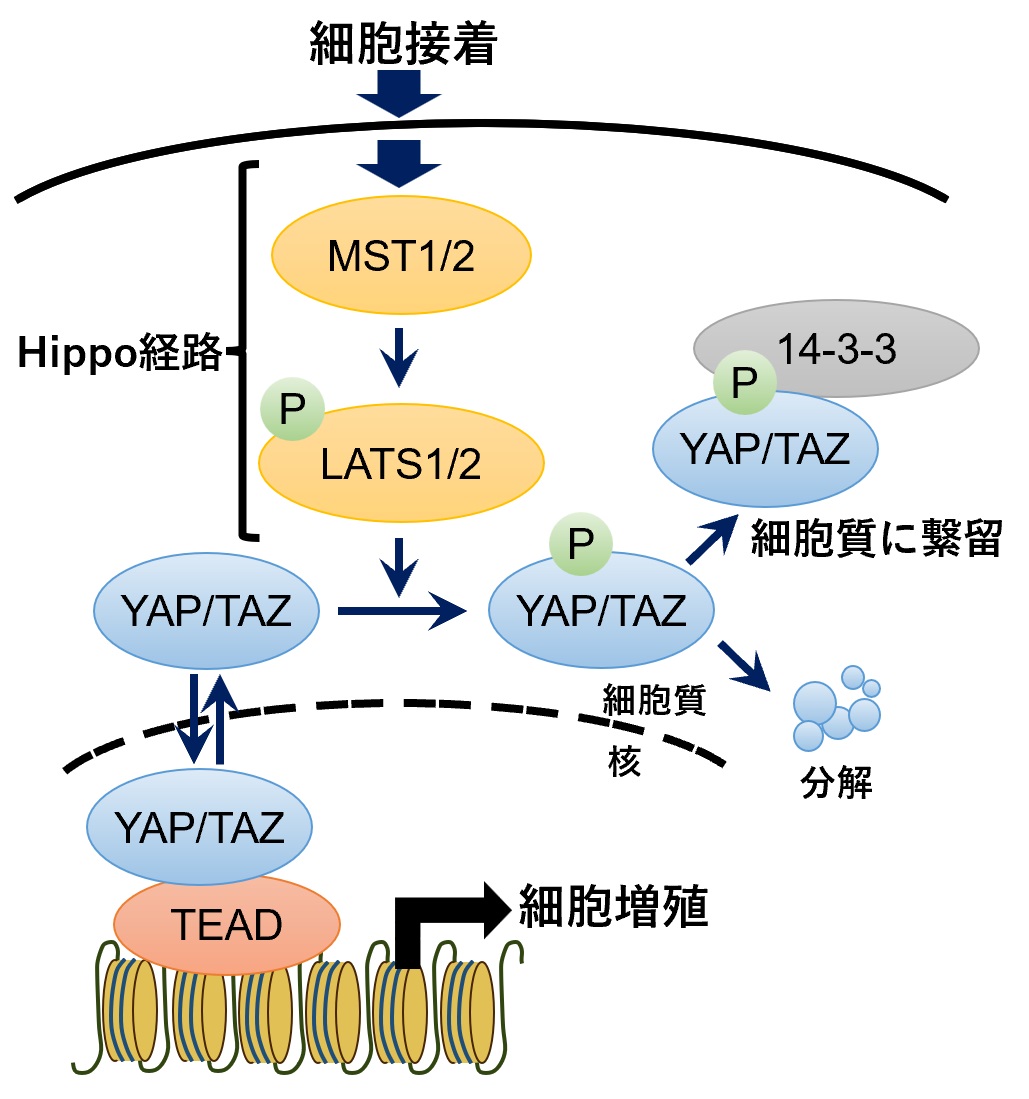
図1:Hippo経路によるTEADの活性制御
TEADが転写因子として機能するためには、その転写共役因子であるYAP/TAZと核内で結合する必要がある。細胞接触等の刺激によりHippo経路を構成するリン酸化酵素 (MST1/2, LATS1/2) が順番に活性化され、最終的にYAP/TAZがリン酸化される。リン酸化されたYAP/TAZは14-3-3と結合することで細胞質に繋留、あるいは分解されることにより、核内に存在するYAP/TAZの量が減少、その結果TEADの転写活性が抑制される。
(拡大画像↗)
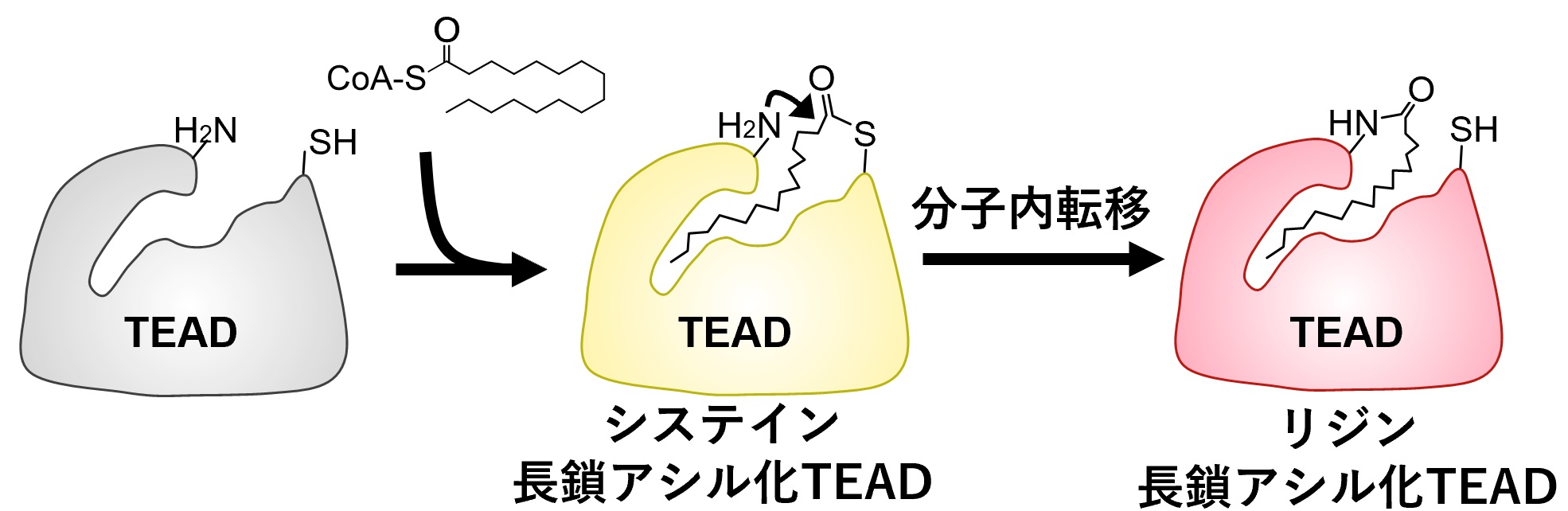
図2:分子内転移によるTEADのリジン長鎖アシル化機構
まず、非酵素的にTEADのシステイン残基が長鎖アシル化される。すると、近傍にあるリジン残基に長鎖アシル基が転移し、リジンの長鎖アシル化が引き起こされる。
(拡大画像↗)
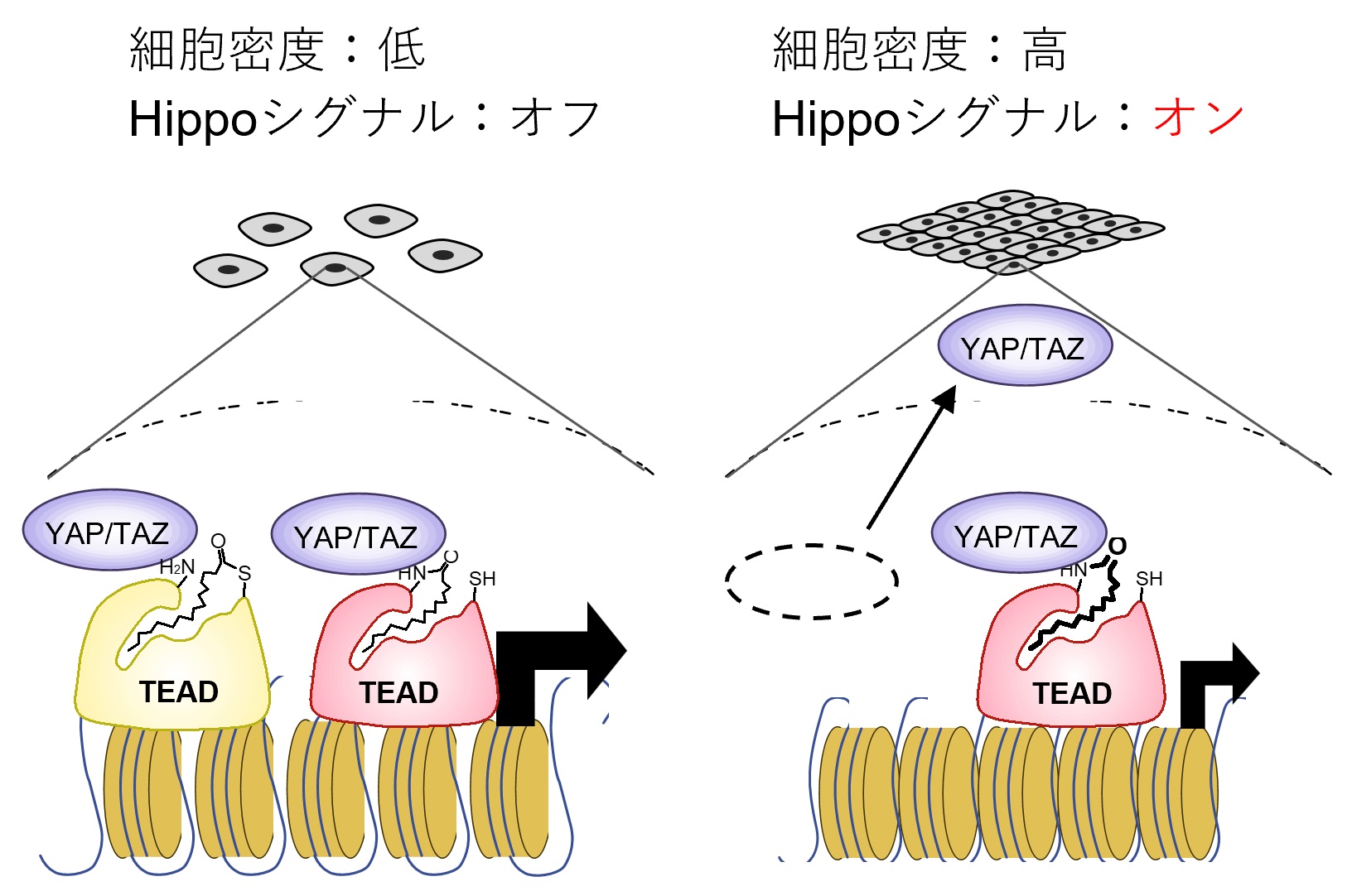
図3:細胞接触におけるTEADのリジン長鎖アシル化の役割
細胞が低密度でHippo経路が不活性化している場合、TEADのリジンおよびシステイン残基の両方が長鎖アシル化された状態にある。細胞が高密度で細胞同士が接触すると、Hippo経路が活性化される。その結果、システインの長鎖アシル化レベルは減少するが、リジンの長鎖アシル化は増加する。この時に増加するリジン長鎖アシル化は、核内に残っているYAP/TAZとの結合を促すことにより、基底レベルでのTEADの活性維持に寄与する。
(拡大画像↗)
〈研究の背景〉
がん抑制経路であるHippo経路(注1)下で働くTEAD(注2)は器官形成や組織分化に重要な転写因子(注3)です。その一方、TEADの異常な活性化は腫瘍形成を招くことから、その活性は厳密に制御される必要があります。TEADが転写因子として機能するためには、その転写共役因子(注4)であるYAP/TAZ(注5)と結合する必要があり、TEADの転写活性は、Hippo経路の構成因子であるリン酸化酵素によるYAP/TAZのリン酸化によって調節されることが知られています (図1)。一方、TEAD自身の翻訳後修飾(注6)による活性制御機構については、システインのパルミトイル化以外はほとんど知られていませんでした。
〈研究の成果〉
最近、リジン残基においてミリストイル化やパルミトイル化などの長鎖アシル化が起こることが明らかになりましたが、リジン長鎖アシル化(注7)されるタンパク質は僅かしか見つかっていませんでした。そこで研究グループは、ショットガン解析(注8)を用いてリジン長鎖アシル化されるタンパク質を網羅的に探索したところ、TEADにおいて種を越えて保存されているリジン残基が長鎖アシル化されることを発見しました。そこでまず、TEADがリジン長鎖アシル化されるメカニズムを調べました。最近、TEADのシステイン残基がパルミトイル化され、システインパルミトイル化はTEADの安定性やYAP/TAZとの結合に影響を及ぼすことが報告されました。アシル化されるシステイン残基とリジン残基は結晶構造中で隣接していることから、アシル基が近接したシステイン残基からリジン残基へと分子内転移を起こしていると考えられました(図2)。そこで、アシル化されるシステイン残基をセリンに置換することでアシル化されなくした変異体を発現させると、システインだけでなくリジンの長鎖アシル化も起こらなくなることが分かりました。すなわち、TEADは自己触媒活性によってリジン長鎖アシル化されるのです。
次に、機能について調べました。長鎖アシル化されるリジン残基をアルギニンに置換し、長鎖アシル化できなくすると、TAZ/YAPとの結合活性およびTAZ/YAP依存的な転写活性が顕著に低下することが分かりました。これらの結果から、リジン長鎖アシル化はYAPおよびTAZとの結合活性を増強することにより、YAP/TAZ依存的なTEADの転写活性を促進させることが示唆されました。これまで報告されているリジン長鎖アシル化の機能としては、細胞膜への結合活性に関するものばかりです。今回の研究は、リジン長鎖アシル化による転写制御機構の存在を世界で初めて明らかにする成果となりました。
さらに、TEADのリジン長鎖アシル化の生理的な役割について検討しました。正常細胞間同士が接触すると細胞増殖が停止することが知られています。このことを接触阻害と言いますが、細胞接触によりHippo経路が活性化され、その結果、TEADの活性化が抑制されることにより細胞の増殖が停止します(図1)。そこで、細胞接触により、TEADのリジン長鎖アシル化レベルが変化するかどうか調べました。その結果、システインのパルミトイル化レベルは減少する一方、予想に反して、細胞接触によって、TEADのリジン長鎖アシル化レベルは増加しました。この時、リジン長鎖アシル化を出来なくしておくと、TEADの転写活性がさらに低下することを見出しました。細胞接触によりHippo経路が活性化するとTEADの活性は低下しますが、ゼロにはならず、低いレベルで転写活性は維持されています。TEADのリジン長鎖アシル化はシステイン長鎖アシル化に比べてはるかに安定であることから、リジン長鎖アシル化はHippo経路が活性化した時に、基底レベルでのTEADの転写活性の維持に重要な役割を果たしていると考えられます(図3)。
〈今後の展望〉
今回、研究グループは、リジン長鎖アシル化はTEADの転写活性に重要な役割を果たすことを突き止めました。この研究成果から、リジン長鎖アシル化を阻害する小分子化合物は、TEADの転写活性を抑制することが期待でき、TEADを標的とした新規作用機序を有する抗がん剤として有望です。今後、そのような化合物を探索・同定することにより、新しいがん治療薬の創製を目指したいと考えています。
発表雑誌
- 雑誌名
- Cell Reports
- 論文タイトル
- Lysine long-chain fatty acylation regulates the TEAD transcription factor
- 著者
- Kota Noritsugu, Takehiro Suzuki, Kosuke Dodo, Kenji Ohgane, Yasue Ichikawa, Kota Koike, Satoshi Morita, Takashi Umehara, Kenji Ogawa, Mikiko Sodeoka, Naoshi Dohmae, Minoru Yoshida, Akihiro Ito
研究助成
本研究は、日本学術振興会(JSPS)基盤研究(B)「リジン長鎖脂質修飾による細胞制御機構の解明」(研究代表者:伊藤昭博、研究分担者:堂前直)、同基盤研究(S)「革新的化学遺伝学による内在性代謝物の新機能の解明と応用」(研究代表者:吉田稔、研究分担者:伊藤昭博)、同基盤研究(S)「環境中親電子物質エクスポソームとそれを制御する活性イオウ分子」(研究代表者:熊谷嘉人、研究分担者:伊藤昭博)、同挑戦的研究(萌芽)「転写因子TEADは初めてのタンパク質リジン長鎖アシル基転移酵素か?」(研究代表者:吉田稔、研究分担者:伊藤昭博)、同若手研究「TEADのアセチル化、長鎖アシル化修飾間クロストークによる新規活性制御機構の解明」(研究代表者:則次恒太)、国立研究開発法人日本医療研究開発機構(AMED)B型肝炎創薬実用化等研究事業「次世代抗B型肝炎ウイルス薬導出に向けた創薬研究」(研究代表者・小嶋総一、松浦知和、研究分担者:堂前直)による助成を受けて行われました。
用語解説
- 注1 Hippo経路
細胞の増殖、生死を介して器官サイズを調節するシグナル伝達経路。がん抑制経路でもある。リン酸化酵素カスケードにより構成されている。 - 注2 TEAD
細胞の増殖、生死、分化に関わる遺伝子の発現を調節する転写因子。Hippo経路によって活性が制御されている。 - 注3 転写因子
特定の配列のDNAを認識して結合し、近傍の遺伝子の転写を制御するタンパク質。 - 注4 転写共役因子
DNAと直接結合しないで、転写因子と結合することで標的遺伝子の転写を調節するタンパク質。 - 注5 YAP/TAZ
TEADと結合することで、TEADが標的とする遺伝子の発現を誘導する転写共役因子。Hippo経路を構成するリン酸化酵素カスケードによりリン酸化されると、細胞質への移行や分解が誘導される。 - 注6 翻訳後修飾
リボソームでタンパク質が合成された後に、タンパク質に付加される修飾のこと。特にリジン残基上で起こるアシル化は、アセチル化やクロトニル化を始め多様な種類が報告されている。 - 注7 リジン長鎖アシル化
翻訳後修飾の一つで、リジン残基側鎖のアミノ基の水素原子をアシル基で置換する反応のこと。中でも、炭素原子が14個のミリストイル基や16個のパルミトイル基により置換することを長鎖アシル化と呼ぶ。 - 注8 ショットガン解析
精製タンパク質ではなく、細胞抽出液などのタンパク質混合溶液を試料とし、タンパク質を断片化したペプチドを質量分析により解析し、試料に含まれるタンパク質や翻訳後修飾を同定する解析手法。
問い合わせ先
<研究に関するお問い合わせ>
東京薬科大学 生命科学部 細胞情報科学研究室 教授 伊藤 昭博
TEL:042-676-6905 mail:aito[アット]toyaku.ac.jp
国立研究開発法人理化学研究所 環境資源科学研究センター グループディレクター/
東京大学 特別教授
吉田稔
mail:yoshida[アット]g.ecc.u-tokyo.ac.jp
日本大学 生物資源科学部 教授 小川 健司
TEL:0466-84-3469 mail:ogawa.kenji[アット]nihon-u.ac.jp
<広報に関するお問い合わせ>
東京薬科大学 総務部 広報課 TEL:042-676-6711 mail:kouhouka[アット]toyaku.ac.jp
国立研究開発法人理化学研究所 広報室 報道担当 TEL:050-3495-0247 mail:ex-press[アット]ml.riken.jp
東京大学大学院農学生命科学研究科・農学部事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)
TEL:03-5841-8179 mail:koho.a[アット]gs.mail.u-tokyo.ac.jp
日本大学生物資源科学部庶務課 TEL:0466-84-3800 mail:brs.koho[アット]nihon-u.ac.jp
[アット]を@に変えてください。

