マウス精巣から卵巣への性転換! ――胎子精巣内に眠る卵巣前駆細胞の発見――
発表のポイント
- マウス胎子の精巣からセルトリ細胞を除去すると、残った精巣から卵巣組織が誘導され、オスからメスへの性転換が起きることを発見した。
- ほ乳類の精巣・卵巣への性分化は、オスとメスで同一の前駆細胞から分化するという今までの概念とは異なり、胎子の精巣内では卵巣の前駆細胞が眠った状態で維持されていることが判明した。
- 精巣内の卵巣前駆細胞の存在は、今後ヒトや家畜の性分化異常症の一要因として、その病態の理解に大きく貢献する。
発表概要
東京大学大学院農学生命科学研究科獣医解剖学研究室の金井克晃教授率いる研究チームは、AMH-treckトランスジェニック(Tg)マウス系統(注1)を用いて、胎子精巣からセルトリ細胞(注2)をジフテリア毒素により実験的に除去することで、精巣上皮から顆粒層細胞(注3)を含む卵巣皮質が形成され、精巣間質では卵巣特有の内莢膜細胞が出現することを発見した。この精巣から卵巣への性転換は、セルトリ細胞から分泌されるパラクライン因子(注4)の供給停止によるものである。今までは、未分化な性腺の雌雄共通の前駆細胞から、オス型のセルトリ細胞、メス型の顆粒層細胞(ステロイドホルモン産生細胞は、オス型のライディッヒ細胞とメス型の内莢膜細胞)が分化し、精巣・卵巣へと発達すると考えられていた。本成果により、オス・メスで別々の前駆細胞から精巣・卵巣が発達し、セルトリ細胞由来のFGF9がメスの卵巣前駆細胞の出現を抑制していることも新たに判明した。胎子期の精巣で卵巣前駆細胞が維持されている事実は、マウスだけでなく、ヒトや家畜の性分化異常症での卵巣前駆細胞の性的2型の破綻の一原因として考えられ、ほ乳類の生殖腺の機能障害の病因の深い理解に貢献する。
発表内容
〈研究の背景〉
ほ乳類の性別は、胎子期の未分化な性腺が、精子を作る精巣、あるいは卵子を育む卵巣のどちらに発達するかにより決まる。オスの胎子では、未分化な性腺でオス型のセルトリ細胞が誘導され、この誘導されたセルトリ細胞から分泌される様々なパラクライン因子により他の全ての性腺の細胞がオス型へと分化し、その結果として精巣を構築する。一方、メスの胎子では、未分化な性腺でセルトリ細胞の代わりにFOXL2陽性(FOXL2+)の顆粒層細胞が誘導される。セルトリ細胞が誘導されず、パラクライン因子が分泌されないため、他の全ての性腺の細胞がメス型の卵巣へと誘導されることが知られていた。今まで、卵巣を構築する卵巣体細胞は、精巣と同一の前駆細胞からの性分化により生じるという概念が主流であり、また卵巣を形作る前駆細胞が、どこに存在し、どのように卵巣を構築するのかは謎に包まれていた。
〈研究の内容〉
本研究チームでは、セルトリ細胞に特異的にジフテリア毒素(DT)受容体を発現するAMH-treck Tgマウスを独自に作出しており、これを利用して、胎齢12.5日の胎子の精巣からセルトリ細胞を除去し、その後の残された精巣の動態をRNA seqにより継時的な遺伝子の発現変化を解析した。その結果、セルトリ細胞除去後、Foxl2、 Fst、 Gng13などを含む39遺伝子(35.1%), 102遺伝子(22.0%)の卵巣特異的遺伝子が時間経過とともに上昇することが判明した。卵巣体細胞マーカーであるFOXL2+細胞は、精巣上皮の下層、中腎側の間質領域に別々に出現し、さらに生き残った生殖細胞も減数分裂を開始しメス型に分化していた。つまり、セルトリ細胞除去後、精巣から卵巣への性転換が誘導されたことが判明した(図1)。
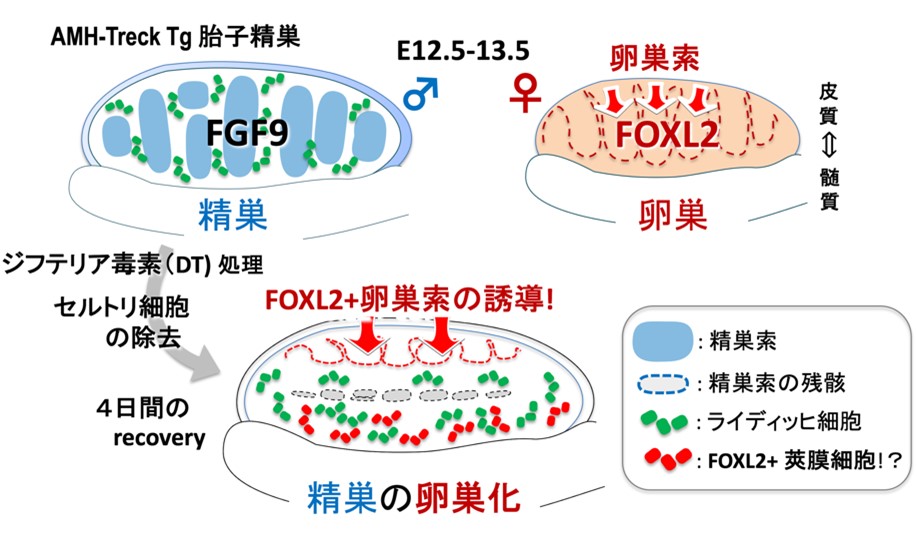
図1:マウス精巣から卵巣への性転換.
セルトリ細胞にジフテリア毒素(DT)受容体を発現させたトランスジェニック(Tg) マウスを用いて、DT 処理によりセルトリ細胞を除去するとともに、セルトリ細胞から分泌されるパラクライン因子を除去した。その結果、精巣上皮からFOXL2+顆粒層細胞を含む卵巣皮質が誘導され、間質領域ではライディッヒ細胞周辺からFOXL2+内莢膜細胞が誘導された。このことからほ乳類の胎子精巣にFOXL2+の卵巣前駆細胞が維持されていることが判明した。
上皮直下で誘導されたFOXL2+細胞は、卵巣でみられる皮質索様の肥厚(卵巣索)に類似し、卵巣索マーカーであるLgr5、 Gng13の発現誘導も確認された。精巣上皮のQdot probe(蛍光ナノクリスタル)標識による追跡実験、EdUによる細胞増殖解析により、FOXL2+細胞の一部は、精巣上皮からの増殖を経て出現していることが判明し、セルトリ細胞の除去により精巣上皮からのFOXL2+顆粒層細胞を含む卵巣索が形成されていることが証明された。一方、中腎側のFOXL2+細胞は、ライディッヒ細胞に近接して出現し、GFP標識の中腎細胞の追跡実験、さまざまなマーカーの発現解析から内莢膜細胞に相同する細胞であることが示唆された。さらに、この性転換に関与するセルトリ細胞のパラクライン因子として、さまざまな分泌因子の中でもFGF9の添加のみでTg精巣でのFOXL2発現誘導が抑制されること、FGFR1/2受容体とヘパラン硫酸プロテオグリカン(FGFリザーバー)が上皮・中腎側領域で発現していることから、胎子セルトリ細胞からのFGF9供給の停止が、精巣から卵巣への性転換の引き金となったものと想定された。
〈今後の展望〉
以上の結果から、胎子精巣内で、メス型の顆粒層細胞、内莢膜細胞の前駆細胞が維持されていること、精巣内でのこれらの卵巣組織は、セルトリ細胞から分泌されるFGF9により、その発達が抑制されていることが判明した。本研究は、精巣と卵巣の体細胞はお互い同一の前駆細胞が存在し、同一の前駆細胞が性分化するという今までの概念とは異なる。この精巣内で卵巣前駆細胞が維持されている新知見は、マウスだけでなく、ヒトや家畜の性分化異常症での性的2型の破綻の原因の一つとして、ほ乳類の生殖腺の機能障害の病因、病態の深い理解に貢献する。
発表者
東京大学大学院農学生命科学研究科 獣医学専攻・獣医学専修
今井松 健也(研究当時:博士課程)
平松 竜司 (助教)
冨田 絢子 (研究当時:学部生)
板橋 寛嗣 (研究当時:学部生)
金井 克晃 (教授)
発表雑誌
- 雑誌
- Development
- 題名
- Partial male-to-female reprogramming of mouse fetal testis by Sertoli cell ablation
- 著者
- Kenya Imaimatsu, Ryuji Hiramatsu, Ayako Tomita, Hirotsugu Itabashi, Yoshiakira Kanai*(*は責任著者)
- DOI
- 10.1242/dev.201660
- URL
- https://journals.biologists.com/dev/article/doi/10.1242/dev.201660/320405/Partial-male-to-female-reprogramming-of-mouse
研究助成
本研究は、「基盤研究(C)(課題番号:22K06022)」「基盤研究(C)(課題番号:19K06397)」「新学術領域研究(課題番号:21H00227)」「新学術領域研究(課題番号:19H05241)」「基盤研究(A)(課題番号:17H01501)」、「先進ゲノム解析研究推進プラットフォーム(課題番号:16H06279)」の支援により実施されました。
用語解説
- 注1 AMH-treckトランスジェニック(Tg)マウス系統
ジフテリア毒素受容体をセルトリ細胞に特異的に発現させたマウス系統で、セルトリ細胞の特異的な除去・置換が可能である。 - 注2 セルトリ細胞
精巣内に存在する直接、生殖細胞を支持する細胞であり、精子の形成に関与している。セルトリ細胞は精巣の性分化において中心的な役割を果たす。 - 注3 顆粒層細胞
卵巣内において直接、生殖細胞を支持し、卵胞の発達・成熟に関与する細胞であり、雄のセルトリ細胞と機能的に相同である。 - 注4 パラクライン因子
細胞の分泌した物質が近くに存在する細胞や組織に直接作用すること。雄化のパラクライン因子として、FGF9(繊維芽細胞成長因子9)以外に、 AMH(抗ミューラー管ホルモン)、 DHH(デザートヘッジホッグ)などが挙げられる。
問い合わせ先
〈研究に関する問合せ〉
東京大学大学院農学生命科学研究科 獣医学専攻 獣医解剖学教室
教授 金井克晃(かない よしあきら)
Tel: 03-5841-5384 Fax: 03-5841-8181
E-mail: ykanai[アット]g.ecc.u-tokyo.ac.jp
〈報道に関する問合せ〉
東京大学大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)
Tel: 03-5841-8179 Fax:03-5841-5028
E-mail:koho.a[アット]gs.mail.u-tokyo.ac.jp
※[アット]を@に変えてください。

