抗てんかん薬が効く仕組みを解明 -新たな抗てんかん薬やPETプローブの開発に寄与-
概要
理化学研究所(理研)生命機能科学研究センタータンパク質機能・構造研究チームの山形敦史上級研究員、白水美香子チームリーダー、環境資源科学研究センター生命分子解析ユニットの堂前直ユニットリーダー、鈴木健裕専任技師、東京大学大学院農学生命科学研究科応用生命工学専攻の寺田透教授らの共同研究グループは、抗てんかん[1]薬レベチラセタムとブリバラセタムが作用する機構を、その標的である膜タンパク質[2]の立体構造に基づいて解明しました。
本研究成果は、新しいてんかん治療薬や、PET(陽電子放射断層撮影法)[3]用のプローブの開発に貢献すると期待できます。
新しいタイプの抗てんかん薬として注目を集めるレベチラセタムとブリバラセタムは、神経細胞に存在する膜タンパク質であるSynaptic vesicle glycoprotein 2A(SV2A)[4]に作用します。SV2Aは神経細胞間の連結部であるシナプス[5]において神経伝達物質[6]の放出を担うシナプス小胞[5]に存在し、神経毒であるボツリヌス毒素[7]の受容体としても知られています。SV2Aは医学的には重要な標的であるにもかかわらず、その機能はほとんど分かっていません。
今回、共同研究グループは、SV2Aとレベチラセタムおよびブリバラセタム、ボツリヌス毒素との複合体の立体構造をクライオ電子顕微鏡[8]を使って解析しました。これにより、抗てんかん薬やボツリヌス毒素がSV2Aに結合する仕組みが明らかとなり、ブリバラセタムがレベチラセタムよりも高い薬効を示す構造的な理由が示されました。
本研究は、科学雑誌『Nature communications』オンライン版(4月18日付:日本時間4月18日)に掲載されました。
SV2A–A型ボツリヌス毒素受容体結合部位–抗てんかん薬の複合体構造
発表内容
背景
てんかんは人口の1%程度の人が発症する高頻度の神経疾患であり、神経の異常な興奮によって引き起こされると考えられています。てんかんの発作は予測が困難で、時には死に至る危険なものですが、抗てんかん薬の服用により発作を抑え通常の生活を送れるようになっています。これまでに開発された抗てんかん薬の多くは、神経細胞の情報伝達を担っているイオンチャネル[2]を標的としています。
一方、第二世代の抗てんかん薬の一つで副作用が少ないという特徴を持つレベチラセタムや、レベチラセタムを基に、より薬効を改善したブリバラセタムは、イオンチャネルではなく、膜輸送体[2]と考えられるSynaptic vesicle glycoprotein 2A(SV2A)に作用します。しかし、これらの抗てんかん薬がどのようにSV2Aに作用するのかは明らかになっていません。
またSV2Aは多くの神経細胞でシナプスに発現しており、レベチラセタムを基に開発されたPETプローブが脳内におけるシナプス密度のイメージングに使われています。高齢化社会の到来に伴い、認知症関連の診断などPETイメージングの需要は高まっていくと予想されます。レベチラセタムとSV2Aの結合様式の解明は、新たなPETプローブの設計にも重要です。
さらにSV2Aは、自然界に存在する最も強力な毒素である神経毒ボツリヌス毒素の受容体としても機能します。ボツリヌス毒素はボツリヌス菌によって産生され、蜂蜜による乳児ボツリヌス症や、加圧加熱殺菌されていない真空パック詰食品での食中毒など、これまでにも深刻な中毒症が多く報告されています。一方、ボツリヌス毒素は強力な神経阻害作用を薬として利用することも可能で、まぶたや顔の痙攣(けいれん)、手足の痙縮(けいしゅく)の治療などに用いられています。ボツリヌス毒素はA型からG型まで七つの型に分けられ、治療目的用のものではA型がSV2Aを受容体とします。しかしこれまで、SV2AとA型ボツリヌス毒素との複合体の立体構造は得られていませんでした。
研究手法と成果
共同研究グループは、クライオ電子顕微鏡を用いてSV2A、A型ボツリヌス毒素(サブタイプ2)の受容体結合部位、レベチラセタムから成る三者複合体の立体構造を決定しました(図1a)。膜タンパク質の構造解析はクライオ電子顕微鏡の発展により飛躍的に向上しましたが、SV2Aのように分子量が8万程度と比較的小さく、かつ膜外に目印となるような大きな領域のないものについては解析が困難でした。共同研究グループは、A型ボツリヌス毒素の受容体結合部位を目印として利用することで、クライオ電子顕微鏡による解析に成功しました。
今回明らかとなったA型ボツリヌス毒素とSV2Aの複合体の構造から、A型ボツリヌス毒素はSV2Aの膜貫通領域外の小さな領域に結合し、その認識にはSV2Aの糖鎖[9]修飾部位が重要な役割を担っていることが分かりました。得られた構造を基に、これまでに報告されたA型ボツリヌス毒素全長の立体構造データを反映させることで、A型ボツリヌス毒素が神経細胞膜に結合したモデルを構築することができました(図1b)。
図1 クライオ電子顕微鏡によるSV2A立体構造解析
(a)SV2A–A型ボツリヌス毒素受容体結合部位–抗てんかん薬(レベチラセタム)複合体の立体構造。A型ボツリヌス毒素はSV2Aの膜貫通領域外の小さな領域(LD4)と結合する。レベチラセタム(LEV)は、水色と青色のヘリックス(らせん)構造で示すSV2Aの膜貫通領域の内部に結合している。
(b)膜に埋め込まれたSV2Aに、A型ボツリヌス毒素の全長が結合した様子を再現したモデル。A型ボツリヌス毒素と神経細胞膜の結合には、SV2Aの糖鎖と細胞膜表面に存在する糖脂質(ガングリオシド)が関わっている。
SV2Aの膜貫通領域部位は、膜輸送体でよく見られるように、2組のドメインがV字型に配向して、基質が通るための空洞を形成しています(図2a)。抗てんかん薬レベチラセタムはSV2Aの空洞の底部に結合しており、SV2Aが膜輸送体として働く時の基質の結合部位を奪っていると考えられました。なお先行研究では、レベチラセタムとの結合に重要な複数のアミノ酸残基が、SV2Aの変異体実験により同定されています注1-3)。これらのアミノ酸残基のほとんどは、今回明らかになったレベチラセタム結合部位の近傍に位置しており、これまでの研究結果とよく一致しているものでした(図2b)。
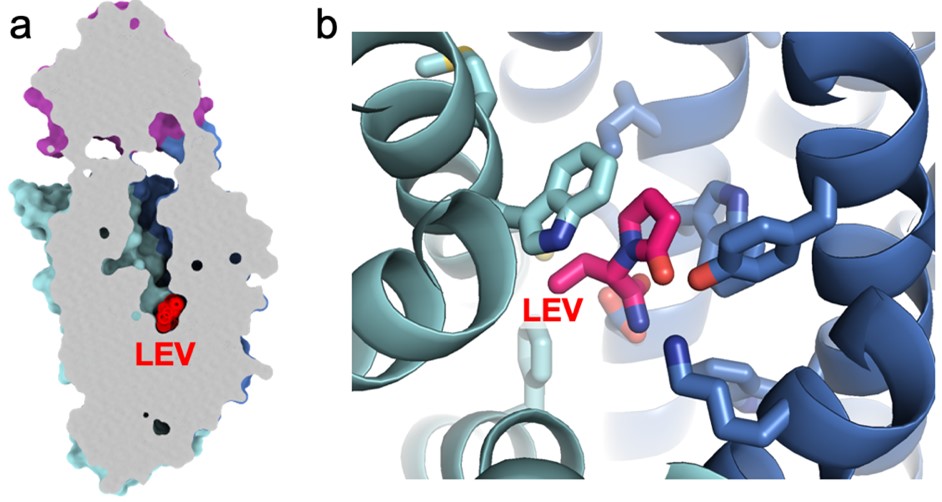
図2 SV2Aと抗てんかん薬(レベチラセタム)の結合
(a)SV2A膜貫通領域部位の空洞に結合するレベチラセタム(LEV)。SV2Aの内部構造を示すため、断面(灰色)図としている。上部の紫色の領域は、図1で示したSV2Aの膜貫通領域外の小さな領域(LD4)。
(b)レベチラセタムと、先行研究で同定された相互作用に関わる残基をスティックモデルで示した。リボンモデルは膜貫通領域部位の空洞を構成するアルファヘリックスの主鎖を示す。
同様にして、抗てんかん薬ブリバラセタムとの複合体の構造解析も行いました。ブリバラセタムはレベチラセタムにプロピル基が付加した構造をとっており、SV2Aへの結合がレベチラセタムより強いという特徴があります。得られた構造から、プロピル基が461番目のチロシン残基および663番目のイソロイシン残基と新たな相互作用を生み出していることが分かりました(図3a)。そこで、この新たな相互作用が実際にブリバラセタムの強い結合に関与しているかを定量的な相互作用解析によって確認するため、SV2A内のトリプトファン残基の蛍光を利用した測定系を開発しました。トリプトファンはタンパク質を構成するアミノ酸の一つで、蛍光を発することが知られています。この蛍光はトリプトファン残基周囲の環境によって変化することから、SV2Aのブリバラセタム結合部位にあるトリプトファン残基の変化を検出することができると考えました。この測定系を用いて、461番目のチロシン残基および663番目のイソロイシン残基の変異体とブリバラセタムの結合を測定したところ、ブリバラセタムへの結合が弱くなっており、クライオ電子顕微鏡の構造解析で見られたプロピル基とこれら二つのアミノ酸残基との相互作用がブリバラセタムの強い結合を生み出していることが確認されました。
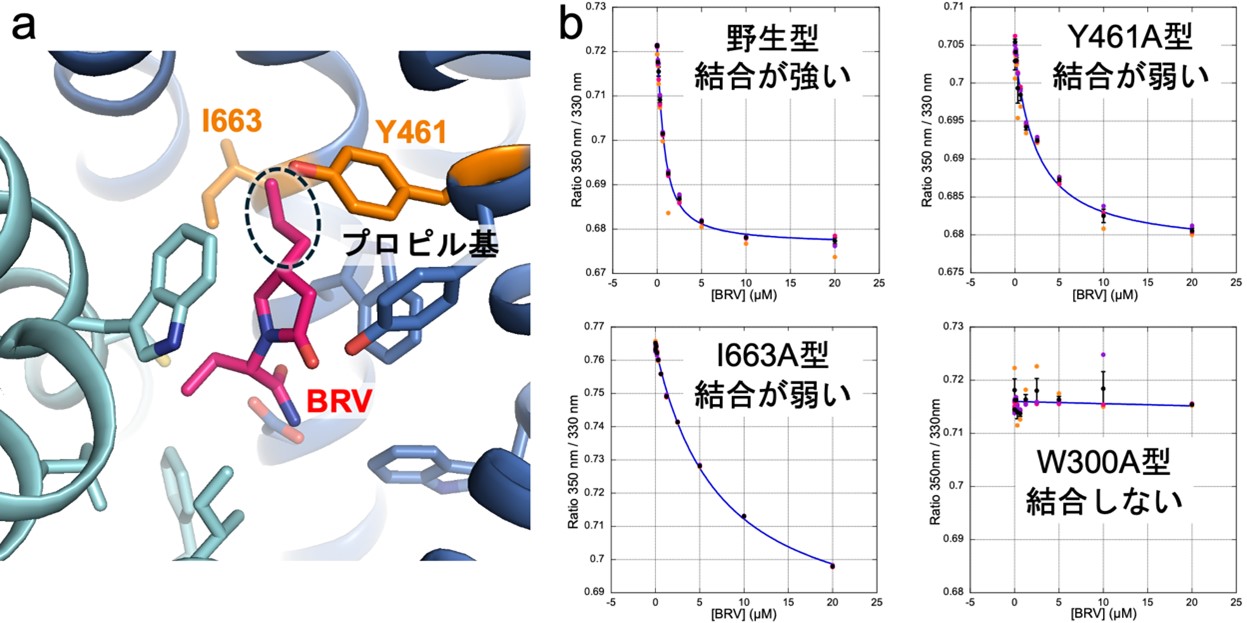
図3 SV2Aと抗てんかん薬ブリバラセタムの相互作用解析
(a)ブリバラセタム(BRV)の結合部位。ブリバラセタムは、レベチラセタムに破線で囲んだプロピル基が付加した構造をとる。このプロピル基は、SV2Aの461番目のチロシン残基(Y461)および663番目のイソロイシン残基(I663)との新たな相互作用を生み出している。
(b)トリプトファン残基の蛍光を利用した、ブリバラセタムとSV2A野生型およびSV2A変異体の相互作用解析。グラフは、トリプトファンが発する自家蛍光である350ナノメートル(nm、1nmは10億分の1メートル)と330nmの蛍光強度の比(縦軸)を測定することにより、測定系に加えたブリバラセタム濃度(横軸)依存的に生じる微小な構造変化を高精度で測定した。SV2A野生型では、わずかな量のブリバラセタムの添加で蛍光強度比が大きく変化し、ブリバラセタムがSV2Aに強く結合することを示す。一方、461番目のチロシン残基や663番目のイソロイシン残基を、構造の大きく異なるアラニンに変えたSV2A変異体(Y461A型、I663A型)は、ブリバラセタムを多く添加しないと蛍光強度比の変化が見られなかった。なお変異体W300A型は、ブリバラセタムが結合しない対照実験として示した。
注1)Shi, J. et al. Combining modelling and mutagenesis studies of synaptic vesicle protein 2A to identify a series of residues involved in racetam binding. Biochem Soc Trans 39, 1341-7 (2011).
注2)Wood, M.D., Sands, Z.A., Vandenplas, C. & Gillard, M. Further evidence for a differential interaction of brivaracetam and levetiracetam with the synaptic vesicle 2A protein. Epilepsia 59, e147-e151 (2018).
注3)Lee, J. et al. Exploring the interaction of SV2A with racetams using homology modelling, molecular dynamics and site-directed mutagenesis. PLoS One 10, e0116589 (2015).
今後の期待
本研究により、非イオンチャネルを標的とする抗てんかん薬の認識機構が詳細に解明されました。今回の成果は、SV2Aを標的とする新たな抗てんかん薬やPETプローブの効率的・論理的な開発に向けた重要な知見となります。また、ボツリヌス毒素とSV2Aとの結合様式が明らかとなったことにより、ボツリヌス毒素の薬剤応用にも貢献すると期待されます。
さらに、共同研究グループが新たに確立した内在性トリプトファン蛍光を用いた薬剤結合の測定法は、薬剤とタンパク質の相互作用を調べる簡便かつ正確な解析法として広く用いられる可能性を秘めています。
発表者
理化学研究所
生命機能科学研究センター タンパク質機能・構造研究チーム
上級研究員 山形敦史 (ヤマガタ・アツシ)
チームリーダー 白水美香子(シロウズ・ミカコ)
環境資源科学研究センター 生命分子解析ユニット
専任技師 鈴木健裕 (スズキ・タケヒロ)
ユニットリーダー 堂前 直 (ドウマエ・ナオシ)
東京大学 大学院農学生命科学研究科 応用生命工学専攻
教授 寺田 透 (テラダ・トオル)
発表雑誌
- 雑誌
- Nature Communications
- 題名
- Structural basis for antiepileptic drugs and botulinum neurotoxin recognition of SV2A
- 著者
- Atsushi Yamagata, Kaori Ito, Takehiro Suzuki, Naoshi Dohmae, Tohru Terada, Mikako Shirouzu
- DOI
- 10.1038/s41467-024-47322-4
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、理化学研究所独創的研究課題「細胞内環境の生物学」「長時間分子生物学」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「クライオ電顕を用いた鉄錯体輸送体の基質認識と輸送機構の解明(研究代表者:山形敦史)」、日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)「分子シミュレーションによる生体高分子の機能の予測と解析(代表者:寺田透)」による助成を受けて行われました。
用語解説
- 注1 てんかん
さまざまな原因によって引き起こされる慢性の脳疾患。大脳の神経細胞の過剰な放電(興奮)によって繰り返し引き起こされる反復性の発作を特徴とし、変異に富む臨床症状や検査所見を伴う。発症率は人口の0.5~1%である。中でも発作がある程度の長さ以上続く状態、または短い発作の場合でも繰り返し起こって、その間の意識の回復がないものをてんかん重積状態と呼び、生命に危機が及ぶ可能性がある。 - 注2 膜タンパク質、イオンチャネル、膜輸送体
膜タンパク質は、受容体やチャネル、膜輸送体など、細胞膜や細胞内小器官の膜の中で働くタンパク質の総称。イオンチャネルは、イオンを受動的にかつ非常に速く(1秒当たり100万~1億個程度)生体膜を透過させる機能を持ち、神経細胞においては電気信号を生み出し伝える重要な役割を担っている。膜輸送体は、イオンだけでなくアミノ酸などの物質を生体膜を透過して輸送する。チャネルと比べてその速度は極めて遅い(1秒当たり100~1万個程度)。 - 注3 PET(陽電子放射断層撮影法)
陽電子を放出する放射性同位体を薬などの分子に組み込んで個体に投与し、体内で崩壊して放出されるγ線を測定して分子の体内分布を見る方法。PETはPositron Emission Tomographyの略。 - 注4 Synaptic vesicle glycoprotein 2A(SV2A)
シナプス小胞タンパク質2A。シナプス小胞からの神経伝達物質の分泌を調節する膜タンパク質であり、SV2A遺伝子の変異はてんかん発症に関わる。 - 注5 シナプス、シナプス小胞
神経細胞と神経細胞をつなぐ連結部をシナプスと呼ぶ。神経細胞の軸索側の前シナプスと樹状突起側の後シナプスから成る非対称の構造体であり、その間にはシナプス間隙(かんげき)と呼ばれる隙間がある。前シナプスは神経伝達物質の放出、後シナプスは神経伝達物質の受容にそれぞれ特化している。シナプス小胞は、前シナプスに存在する直径40nm程度の顆粒。神経伝達物質が貯蔵されており、前シナプスの細胞膜と融合することにより、シナプス間隙に神経伝達物質を放出する。 - 注6 神経伝達物質
シナプスにおいて神経細胞の興奮、抑制を伝える物質。グルタミン酸などのアミノ酸、ドーパミン、セロトニンなどのモノアミン類、アセチルコリンなどが含まれる。 - 注7 ボツリヌス毒素
ボツリヌス菌(Clostridium botulinum)により産生される神経毒の一種で、自然界に存在する最も強力な毒素として知られる。摂取すると神経麻痺(まひ)性の疾患(ボツリヌス症)を引き起こす一方、痙攣(けいれん)や痙縮(けいしゅく)などの治療薬としても用いられる。シワ取りなどの美容目的で用いられることも多い。 - 注8 クライオ電子顕微鏡
液体エタン(-183~-160℃)中で急速に凍結させることにより非晶質氷に閉じ込めた試料を、液体窒素温度(-196℃)で観察する電子顕微鏡。生体分子が生体内に存在している状態と同様の水溶液中に居る状態を電子顕微鏡で観察できる。 - 注9 糖鎖
細胞膜の表面に存在する糖が連なった鎖。糖鎖はタンパク質や脂質に結合して細胞表面に提示され、細胞間の情報伝達や識別、細菌の感染などさまざまな機能が知られている。
問い合わせ先
<機関窓口>
理化学研究所 広報室 報道担当
Tel: 050-3495-0247
Email: ex-press [at] ml.riken.jp
東京大学 大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 広報情報担当 Tel: 03-5841-8179、03-5841-5484 Fax: 03-5841-5028
Email: koho.a [at] gs.mail.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。

