KAI2由来生理現象解明を可能にするKAI2阻害剤を発見 ――作物の潜在的な能力応用へ――
研究成果のポイント
- 植物が燃焼する際に生じる煙由来分子として植物の成長と発達を制御するカリキン(KARs)の受容体KAI2に選択的に作用する世界初の阻害剤KK181N1を開発し、その結合様式を明らかにすることでKAI2機能解明を可能にしただけでなく、さらなる高活性型KAI2阻害剤創製の道筋を示すことに成功しました。
- KAI2阻害剤の発見により、互いの作用が似ているためにこれまでは単独の機能解析が困難であったKARs信号とストリゴラクトン(SLs)信号により生じる生理現象の違いを明確に示すことを可能にする世界初の化学ツールを提供することができました。
- この化合物を応用して多様な作物におけるKAI2受容体の機能を解明することで、作物の生育を促進させたり、ストレス耐性を高めたりといった、作物の潜在的な能力を引き出すことが期待できます。
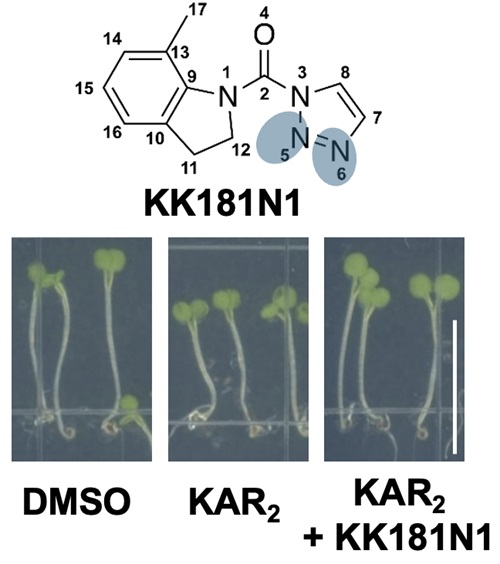
KAI2阻害剤KK181N1の構造(上段)とカリキン(KAR2)の胚軸伸長抑制効果を打ち消すKK181N1の効果(下段)
研究概要
東京大学大学院農学生命科学研究科の浅見忠男特任研究員(横浜市立大学木原生物学研究所客員教授兼東京大学名誉教授)と京都大学大学院生命科学研究科の宮川拓也准教授らによる研究グループは、煙由来分子カリキン(KARs)の受容体「KAI2」(注1)を選択的に阻害する最初の化合物を開発し、その結合様式を明らかにしました。このトリアゾールウレア型化合物である「KK181N1」は、KAI2に非共有結合的に結合し、モデル植物であるシロイヌナズナのKARs誘導性形質を選択的に抑制することができます。さらに、KK181N1はKARs受容体と類似した機能や化合物受容性を持つストリゴラクトン(SLs)受容体「D14」(注1)を介したSLs信号には作用せず、KARs信号に特異的に拮抗することが確認されました。この発見により、類似した作用を示すKARsとSLsの生理機能を区別することが可能となります。本研究は、KARsの基礎研究および農業応用への新たな展望を示しています。

図1:KAI2によるKK181N1の認識
a) シロイヌナズナ由来KAI2(AtKAI2)とKK181N1の複合体結晶構造
b) AtKAI2に対するKK181N1の結合を示すITC(等温滴定熱量測定)熱量曲線
研究内容
これまでの先行研究では生理活性物質であるカリキン(KARs)とストリゴラクトン(SLs)に誘導される生理現象が互いに似ているだけでなく、各々の受容体であるKAI2とD14の性質も似ているために、各々の物質により誘導される生理現象を区別することが難しいという問題点が挙げられていました。このたび、本研究チームはトリアゾールウレア型D14共有結合阻害剤で得た結果に着想を得て、世界で初めてKAI2受容体選択的な阻害剤である「KK181N1」の創製に成功しました。
まず、KAI2阻害剤を見つけるため、トリアゾールウレア化合物を含むライブラリーを用いた化学スクリーニングを実施しました。その結果、モデル植物であるシロイヌナズナのKARs誘発性形質(胚軸伸長の抑制)を選択的に抑制するKK181N1を特定しました。さらに、KAI2との結合様式を結晶構造解析により解明し、KK181N1が非共有結合的にKAI2の触媒ポケットに結合することを明らかにしました。この結合には、KK181N1におけるインドール環のメチル基の配向を制御するポケット内部の疎水性残基の配置に加え、ポケット底部の水分子を介した水素結合ネットワークや周辺残基が重要な役割を果たしており、特に触媒三残基(S95-H246-D217)の形成が鍵となっていました(図2)。こうした相互作用により、KK181N1はKAI2に対して高い親和性を示し、KARsと拮抗的に作用すると考えられます。この知見に基づき、KK181N1のより高効率な誘導体KKT3054を設計し、その強力なKARs阻害活性を実証しました(図3)。
また、KK181N1は高温環境下での種子発芽の抑制を逆転させるKARs効果を阻害し、シロイヌナズナやレタスでの胚軸伸長や種子発芽を効果的に抑えることが示されました。一方で、SL異存的に発芽する寄生植物(Striga hermonthica)においては発芽抑制作用を示すことはなく、KK181N1がKARs信号に特化した阻害剤であることを確認しました。
本研究は、化学ツール設計において水分子ネットワークを操作する重要性を強調し、KARs生物学のさらなる理解を促進する新しい手法を提案しています。このKK181N1およびその誘導体は、KARsとSLs信号を区別するための強力なツールとして、植物科学研究および農業への応用に貢献できます。
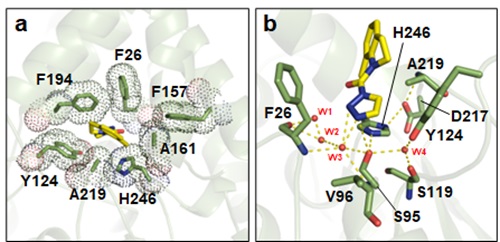
図2:KK181N1の結合様式
a) AtKAI2の触媒ポケットにおいてKK181N1のインドール環と接触する疎水性残基
b) ポケット底部でKK181N1と水素結合ネットワークを形成する残基と水分子(W1‒W4)
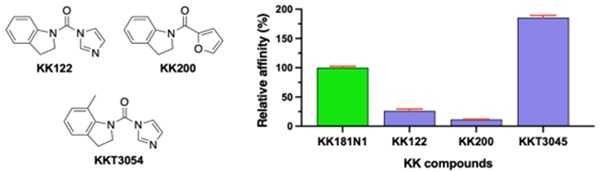
図3:結晶構造に基づいて設計・合成された化合物の構造と活性
ITCにより測定したAtKAI2とKK化合物の結合親和性(Kd値)を用いて算出した相対親和性
発表者
東京大学大学院農学生命科学研究科
浅見 忠男 特任研究員(兼:横浜市立大学木原生物学研究所客員教授 東京大学名誉教授)
研究当時:東京大学大学院農学生命科学研究科 教授
王 建文 研究当時:博士課程
高橋 郁夫 特任研究員
京都大学大学院生命科学研究科
宮川 拓也 准教授
研究当時:東京大学大学院農学生命科学研究科 特任准教授
論文情報
- 雑誌
- Nature Communications
- 題名
- Identification and structure-guided development of triazole urea-based selective antagonists of Arabidopsis karrikin signaling
- 著者
- Jianwen Wang, Ikuo Takahashi, Ko Kikuzato, Toshihiko Sakai, Zhangliang Zhu, Kai Jiang, Hidemitsu Nakamura, Takeshi Nakano, Masaru Tanokura, *Takuya Miyakawa & *Tadao Asami
- DOI
- 10.1038/s41467-024-54801-1
- URL
- https://www.nature.com/articles/s41467-024-54801-1
用語解説
- 注1)カリキン受容体とストリゴラクトン受容体
KARs受容体KAI2とSLs受容体D14はともにα/β-hydrolaseに属する系統的に似た機能と構造をもつ受容体です。またKARsとSLsはその機能が似ているだけでなく、SLs誘導体の異性体はKAI2を活性化できます。そのためにこれまではその生理機能の違いは変異体を用いて解析されてきました。しかしKAI2変異体が知られていない作物では、KARsとSLsの違いを明確にすることは難しいという状況がありました。今回の発見により多様な作物におけるKAI2受容体の機能解析ができるようになり、得られた知見を作物増収に応用することが可能になります。
研究助成
本研究は、科研費「基盤S(課題番号:JP18H05266)」、「基盤A(課題番号:JP18H03939)」、CREST、AMED創薬等先端技術支援基盤プラットフォーム(BINDS)(課題番号:JPama121010)の支援により実施されました。
問い合わせ先
(研究内容については発表者にお問合せください)
東京大学大学院農学生命科学研究科
特任研究員 浅見 忠男(あさみ ただお)
E-mail:asami[at]g.u-tokyo.ac.jp
京都大学大学院生命科学研究科
准教授 宮川 拓也(みやかわ たくや)
E-mail:miyakawa.takuya.7j[at]kyoto-u.ac.jp
東京大学大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)
TEL: 03-5841-8179, 5484 FAX:03-5841-5028
E-mail: koho.a[at]gs.mail.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。

