植物の開花の始まりを抑える未知の遺伝子制御の仕組みを解明 ―植物特異的Dof転写因子はDNA上の近接した結合配列のタンデムリピートに効率的に集積する―
概要
被子植物の実験モデルであるシロイヌナズナにおいては、遺伝子の5%を超える1,500以上の遺伝子が転写因子をコードし、そのうちの45%は植物特異的なファミリーに属していると推計されています。DNA-binding with one-finger(Dof)転写因子は、Dofドメインと名付けられた独特なzinc finger(ZF)型DNA結合ドメインを分子内に1つだけもつ植物特異的な転写因子ファミリーであり、植物の多岐にわたる生理過程の遺伝子発現調節において重要な役割を担っています。しかし、Dofドメインの結合配列はAAAG(またはその逆相補配列CTTT)であり、限られた標的遺伝子のプロモーターをこの4塩基の配列認識でどのようにして特異的に制御できるのか、その分子機構は十分に理解されていませんでした。
京都大学大学院生命科学研究科 宮川拓也 准教授、中野雄司 教授、朱張亮 特定研究員、西田快世 博士課程学生らと、東京大学大学院農学生命科学研究科 柳澤修一 教授、櫻庭康仁 准教授、田之倉優 名誉教授、降旗大岳 博士課程学生(研究当時、現:愛媛大学PROS 学振特別研究員)、大阪大学大学院基礎工学研究科 山下隼人 助教、辻明宏 博士課程学生、阿部真之 教授らの共同研究グループは、Dofドメインの詳細なDNA結合様式を解明しました。さらに、植物が日長を感知して栄養成長から生殖成長へと転換する分子機構で重要な役割を担うDof転写因子のCDF1が、標的遺伝子のプロモーター上で複数の結合配列が近接し縦列に反復した領域(タンデムリピート)に対して効率よく集積することで、標的遺伝子の転写を抑制する分子機構を明らかにしました。Dofドメインの機能を支える構造的特徴は、Dof転写因子ファミリーにおいて高度に保存されており、植物の花成における日長依存性だけでなく、窒素などの土壌からの栄養素吸収や植物ホルモンによる成長調節など、Dof転写因子が関与する多様な転写制御の理解に貢献すると期待されます。
本研究成果は、2025年4月22日に英国の国際学術誌「Nature Plants」にオンライン掲載されました。
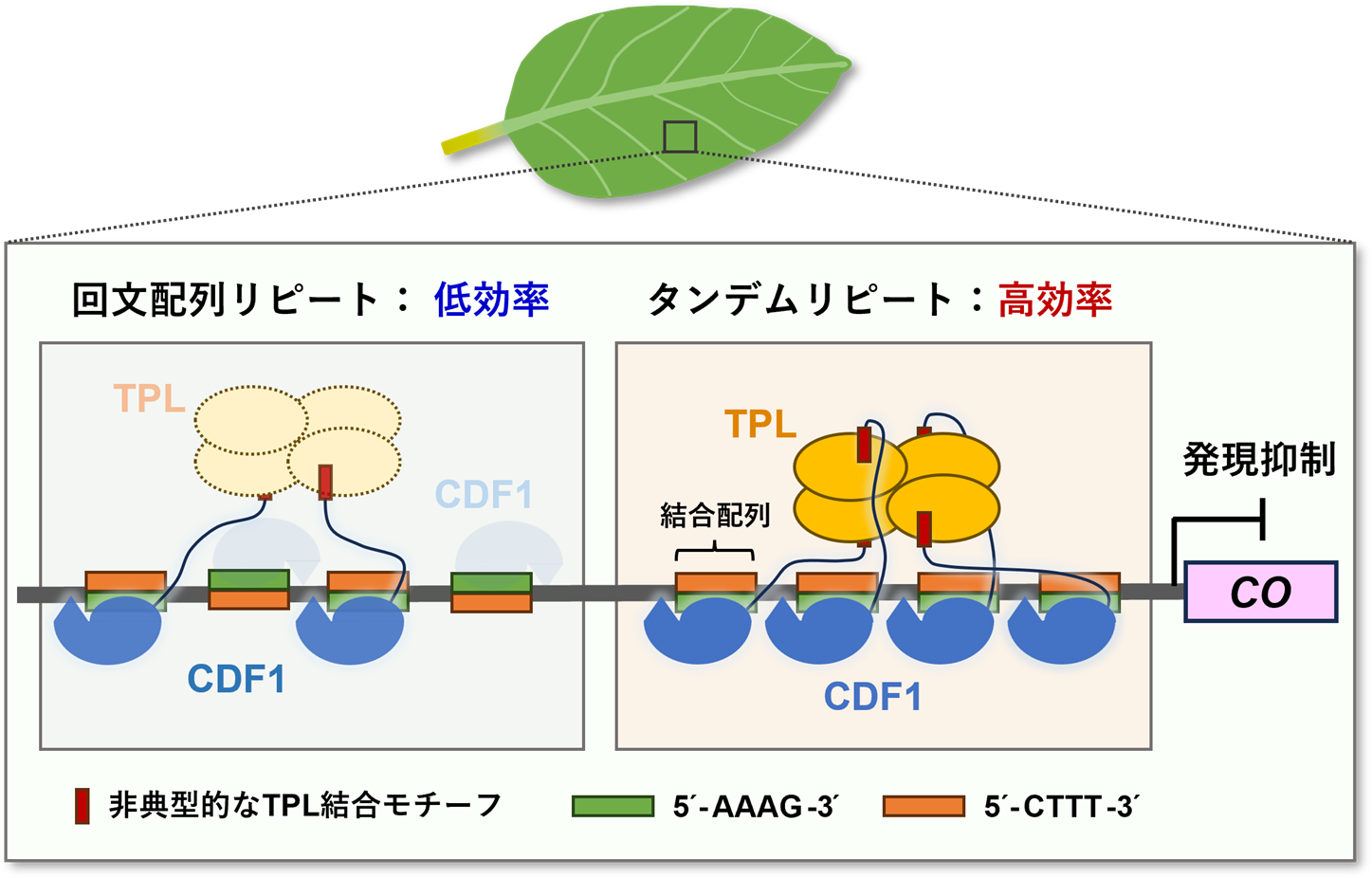
Dof転写因子CDF1による標的遺伝子の効率的な転写抑制機構
植物の葉において、CDF1は標的遺伝子COのプロモーターに存在する4つの近接した(数塩基のリンカーを挟んで並んだ)結合配列のタンデムリピートに効率よく集積する。これにより、タンデムリピートの局所にCDF1の非典型的なTPL結合モチーフが複数配置することで、転写抑制因子であるTPLの四量体(結合部位が4カ所存在)がリクルートされ易くなる。
1.背景
転写因子は主にDNA結合ドメインの種類によって特徴づけられ、標的遺伝子のプロモーターに特異的に結合することで、植物のライフサイクルに関連する複雑な生理過程の遺伝子発現調節を担います。被子植物の実験モデルであるシロイヌナズナ(Arabidopsis thaliana)においては、転写因子をコードする遺伝子が1,500以上存在し、これはゲノム全体の5%以上を占めます。また、そのうちの45%は植物特異的なファミリーに属していると推計されています。DNA-binding with one-finger(Dof)転写因子は、植物特異的な転写因子ファミリーであり、Dofドメインと名付けられた独特なzinc finger(ZF)型DNA結合ドメイン※1を分子内に1つだけ有することを特徴としています。Dof転写因子は、光周期による開花調節、種子発芽、維管束形成、気孔の孔辺細胞の機能化、葉の表裏の極性形成、胚軸の細胞伸長、幹細胞維持、炭水化物代謝、窒素同化などといった多岐にわたる生物学的プロセスに関与することが明らかになっています。このように植物におけるDof転写因子の機能的な重要性については知見が蓄積されてきていますが、Dof転写因子がDofドメインのわずか4塩基の結合配列(AAAGまたはその逆相補配列CTTT)の認識により、限られた標的遺伝子のプロモーターをどのようにして特異的に制御できるのか、その分子機構は十分に理解されていませんでした。
2.研究手法・成果
本研究では、Dof転写因子の中で最も研究が進んでいるCYCLING DOF FACTOR 1(CDF1)に着目しました。CDF1は植物が日長を感知して栄養成長から生殖成長へと転換する分子機構で重要な役割を担い、シロイヌナズナの葉において、CONSTANS(CO)の転写を短日条件下で抑制します。COは花成ホルモンとして知られるフロリゲンをコードする遺伝子FLOWERING LOCUS T(FT)の発現を誘導する転写因子であるため、CDF1は短日条件下で花成の抑制に機能します。
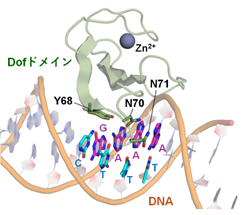
CDF1とその結合配列を含むDNA断片の複合体構造をX線結晶構造解析※2により決定したところ、CDF1は保存された2つのCxxCモチーフに由来する4つのCys残基の側鎖で亜鉛イオン(Zn2+)を配位し、既知のZF型DNA結合ドメインには見られない特有のフォールドを形成していました。3つのβストランドからなる逆平行βシートがDNAの主溝を広げるようにはまり込み、3つのアミノ酸残基(Y68, N70, N71)の側鎖がAAAGの4塩基と水素結合を形成することで、結合配列に対する特異性が生み出されていました(図1)。
図1. CDF1のDofドメインの3残基(Y68, N70, N71)による4塩基(AAAG)の認識
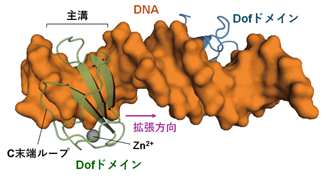
さらに興味深いことに、Dofドメインに特徴的なC末端ループがDNAの副溝とも相互作用することにより、Dofドメインは主溝と副溝を隔てるDNA鎖を挟み込むように結合し、DNAの主溝を広げる方向をC末端ループとは反対側に制御していることが明らかになりました(図2)。この独特な結合様式では、主溝の拡張による副溝の歪みが分散しC末端ループ同士の接触が生じない「タンデムリピート」の場合において、近接した複数の結合配列に対してDofドメインが同時に結合することができます。
図2. Dofドメインの結合に伴う方向性をもった主溝の拡
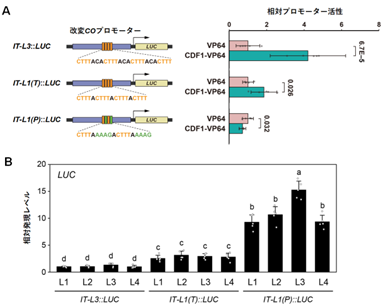
CDF1の標的であるCOのプロモーターには、3塩基以下の短いリンカー配列を挟んで複数の結合配列が近接したタンデムリピートが存在します。COプロモーターには離散的に配置された結合配列も複数見られますが、CDF1はタンデムリピートに対して効率よく作用し下流の遺伝子の転写を調節することが、シロイヌナズナの葉肉プロトプラストを用いたレポーターアッセイによって示されました(図3A)。この作用はシロイヌナズナの形質転換体でも検証され、実際にタンデムリピートを含むプロモーター活性はCOの転写と同様に顕著に抑制されました(図3B)。さらに、等温滴定型カロリメトリー(ITC)※3と高速原子間力顕微鏡(HS-AFM)※4を用いた測定の結果、CDF1のDofドメインはタンデムリピート内の結合配列の数に依存して結合親和性が高まることが明らかになりました(図4)。この親和性の増強効果は、結合配列が数塩基のリンカーで縦列に並んだ場合にのみ観察され、Dofドメインの結合に伴うDNA主溝の方向性をもった拡張により、隣接する結合配列の副溝が他のDofドメインのC末端ループとの相互作用に適した構造へと変化することに起因すると考えられます。CDF1は転写抑制因子のTOPLESS(TPL)をプロモーター上にリクルートするためのTPL結合モチーフをもちます。このモチーフは非典型的な配列ですが、TPLへの結合性が低い配列であっても、それらを4つ連結した場合には四量体のTPLに多価で結合できるために親和性が著しく高まることが報告されています。そのため、COプロモーターにおけるタンデムリピートの局所にDNAを足場としてCDF1の非典型的なTPL結合モチーフが複数配置されることは、TPLのリクルートを介したCOの転写抑制にとって効果的であると言えるでしょう。
図3. タンデムリピート中の近接した結合配列に対する効率的なCDF1の作用
A) 葉肉細胞由来プロトプラストを用いたレポーターアッセイ: CDF1の結合配列を改変した各種COプロモーターに対する活性はLUC活性として検出され、転写活性化配列VP64とそれを融合したCDF1(CDF1-VP64)で比較されている。グラフは平均値±標準偏差(n = 5)で示され、有意差を評価するためのp値(有意水準p < 0.05)が記されている。
B) CDF1による転写抑制活性の植物体での評価:4ライン(L1~L4)のシロイヌナズナ形質転換体において、Aと同じ各種COプロモーターに対する転写抑制活性がLUC活性の検出による相対的な発現レベルとして比較されている。グラフは平均値±標準偏差(n = 5)で示され、異なるアルファベットが付されたデータ間には有意水準p < 0.05で有意差が認められる
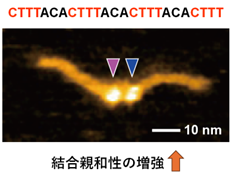
図4. HS-AFMにより観察されたタンデムリピートに対するDofドメインの集積
長時間の測定における代表的なスナップショットが表示されている。下向きの矢じり(ピンク及び青)は4つの結合配列が縦列に配置された200 bpのDNAの中央に結合したDofドメインを示している。
3.波及効果、今後の予定
本研究では、CDF1がそのDofドメインによるAAAGの4塩基の認識を介して、日長に依存した花成誘導の鍵となるCOの転写を抑制するために、そのプロモーターを効率的に制御する仕組みの一端を解明することに成功しました。この仕組みを支えるDofドメインの構造的特徴は、Dof転写因子ファミリーにおいて高度に保存されており、窒素などの土壌からの栄養素吸収や植物ホルモンによる成長調節など、他のDof転写因子が関与する多様な転写制御の理解に貢献すると期待されます。一方、Dofタンパク質が作用し下流の標的遺伝子の転写を制御するプロモーターの中には近接した結合配列のタンデムリピートを含まないものがあります。そのため、本研究で見出されたCDF1のプロモーター標的機能に依存したCOの転写抑制とは異なる作用様式の可能性が示唆され、Dofタンパク質による遺伝子発現調節の全体像のさらなる解明が待たれます。
4.研究プロジェクトについて
本研究は、以下の研究費の支援を受けて実施されました。
日本学術振興会 科学研究費助成事業(JP19H04855, JP22H04977, JP22K18945, JP23H01818, JP23H03073, JP23K27467, JP24KJ1579)、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)(JP24ama121010, JP24ama121001)、筑波大学つくば機能植物イノベーション研究センター 形質転換植物デザイン研究拠点事業(#2102)
<用語解説>
※1 Zinc finger(ZF)型DNA結合ドメイン: Cys残基とHis残基が組み合わされた4残基が亜鉛イオンに配位した構造をとり、DNAに結合する性質をもったタンパク質ドメインのこと。最も典型的なZF型DNA結合ドメインはC2H2クラスで、2つのβストランドからなる逆平行βシートと1つのαヘリックスのββαフォールドをとる。
※2 X線結晶構造解析: タンパク質やDNAなどの生体高分子や低分子化合物の立体構造を原子分解能で決定する方法の一つ。目的の分子または分子複合体の単結晶に様々な角度からX線を照射して得られるX線回折像を解析し、結晶中のX線散乱源である電子密度の空間分布から分子モデルを構築する。
※3 等温滴定型カロリメトリー(isothermal titration calorimetry, ITC):注目している分子の試料溶液に相手分子を一定温度下で少量ずつ滴定し、分子同士の結合に伴って生じる熱量変化を記録することにより、溶液中の分子間相互作用を定量的に測定する方法。解離定数(KD)と結合比(N)に加え、エンタルピー変化(ΔH)やエントロピー変化(ΔS)などの熱力学的パラメーターを得ることができ、タンパク質などの生体分子とリガンドの相互作用の解析に利用されている。
※4 高速原子間力顕微鏡(high-speed atomic force microscopy, HS-AFM): 鋭い針(探針)を試料表面に近づけ原子間力を検出し、その力を一定に保ちながら試料表面上を高速に走査することで物質のミクロな構造とその動きを可視化する顕微鏡。名称は高速AFMと略して呼ばれる。水溶液中のタンパク質の構造変化や分子間相互作用をナノ(10億分の1)メートルの解像度でリアルタイムに観察することができる。
<論文タイトルと著者>
◆タイトル
Structural insights into CDF1 accumulation on the CONSTANS promoter via a plant-specific DNA-binding domain(植物特異的DNA結合ドメインを介したCONSTANSプロモーター上でのCDF1集積の構造的知見)
◆著者
Hirotake Furihata, Zhangliang Zhu, Kaisei Nishida, Yasuhito Sakuraba, Akihiro Tsuji, Hayato Yamashita, Shohei Nosaki, Ryo Tachibana, Ayumi Yamagami, Yoshiki Ikeda, Masayuki Abe, Tatsuya Sawasaki, Takeshi Nakano, Shuichi Yanagisawa, Masaru Tanokura, Takuya Miyakawa
◆掲載誌
Nature Plants
◆DOI
10.1038/s41477-025-01946-6
<報道・取材に関するお問い合わせ先>
京都大学 広報室国際広報班
TEL:075-753-5729 FAX:075-753-2094
E-mail:comms[at]mail2.adm.kyoto-u.ac.jp
東京大学大学院農学生命科学研究科・農学部 事務部 総務課 広報情報担当
TEL: 03-5841-8179, 5484 FAX:03-5841-5028
E-mail:koho.a[at]gs.mail.u-tokyo.ac.jp
大阪大学基礎工学研究科庶務係
TEL:06-6850-6131 FAX:06-6850-6477
E-mail:ki-syomu[at]office.osaka-u.ac.jp
※上記の[at]は@に置き換えてください。
関連教員
柳澤 修一
櫻庭 康仁