飢餓状態の酵母でリボソームが選択的に分解される新経路を発見 ――飢餓適応のメカニズムと分解酵素の多機能性が明らかに――
発表のポイント
◆飢餓状態の酵母において、リボソームが選択的に分解されることを明らかにしました。
◆分解対象リボソームを認識する受容体を同定し、この因子を介した新規分解経路を示しました。
◆本研究は、酵母におけるRNA代謝およびストレス応答機構に関する更なる理解に貢献します。
出芽酵母における新規選択的リボソーム分解経路
概要
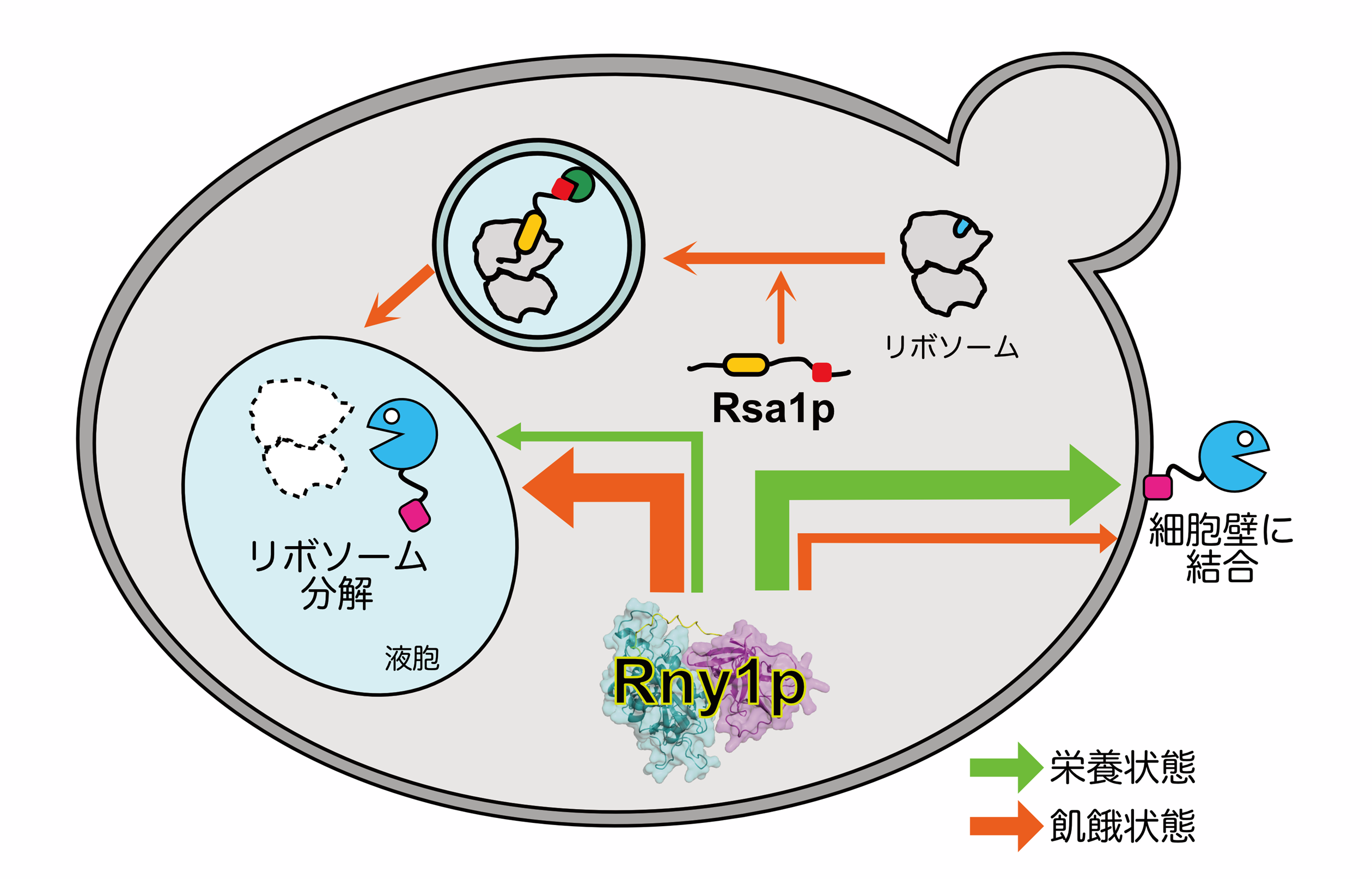
出芽酵母(注1)が窒素飢餓に陥ると、細胞内の余剰リボソーム(注2)が分解されます。しかし、この分解が選択的・非選択的のいずれであるか、議論の余地がありました。東京大学大学院農学生命科学研究科応用生命工学専攻の共同研究グループは、このリボソーム分解が主に「選択的」であることを明らかにしました。また、分解対象リボソームに結合する受容体を明らかにし、リボヌクレアーゼRNase T2(注3)と協働した、新規のリボソーム分解機構を提唱しました。RNase T2は、出芽酵母を含めた幅広い生物に存在し、それぞれの生物種ごとに異なる、多彩な役割を担います。本研究では、RNase T2の「多機能性」を生み出す原動力の一端が、各RNase T2のC末端にある固有な領域にあることも示しました。本研究は、飢餓に応答した酵母リボソーム分解の新たなメカニズムを示すと共に、RNase T2の多様な機能性発揮の理解に迫るものです。
本研究成果は米国生化学・分子生物学会が発行するJournal of Biological Chemistryの2025年6月号に掲載されました。
発表内容
細胞は膨大な量のタンパク質から構成されています。そしてリボソームは、これらタンパク質を合成する、いわば「工場」としての働きをします。タンパク質の合成には多大なエネルギーを必要とします。そのため、細胞は外界を常に監視し、環境状態とタンパク質合成とを調和させます。例えば、栄養が豊富な環境下では、細胞は細胞内のリボソーム量を増やし、これを利用してたくさんのタンパク質を合成し、活発に細胞を増殖させます。一方で、栄養が乏しくなると、細胞は新たにリボソームを作ることを止め、さらにタンパク質合成を停止させます。 そして、細胞内の余剰リボソームは「オートファジー」と呼ばれる機構により分解されることが報告されています。
「オートファジー」(注4)とは、細胞内の不要物を分解し、そのパーツを再利用する作用(自食作用)です。オートファジーは、細胞質の因子を区別なく分解する「非選択的経路」と、特定のものに限定して分解する「選択的経路」とに分けられます。これまで、窒素源飢餓に応答したリボソームの分解は、非選択的・選択的の2つの説があり、意見が分かれておりました。
オートファジーにより液胞(注5)に運ばれたリボソームのうち、リボソームRNA(rRNA)は、リボヌクレアーゼRNase T2により分解されます。RNase T2は、幅広い生物に存在するリボヌクレアーゼであり、出芽酵母ではRny1pと呼ばれます。本研究は、このRny1pの機能解析を目的として進めていましたが、その過程で、酵母におけるこのリボソーム分解が主に「選択的」であることを見出しました。また、Rsa1pとよばれる因子が、分解対象リボソームを認識する「受容体」として機能することを示しました(図1)。Rsa1pはリボソーム大サブユニットの組み立てに関わる因子ですが、本研究では、このRsa1pが、逆にリボソームの分解にも関わることを示しました。
Rny1pは高温や浸透圧ストレス、飢餓条件における生育に必要です。Rny1pの遺伝子を欠損した細胞に対して窒素源飢餓を誘導すると、非選択的オートファジーの活性が低下しました。これは、液胞での未分解rRNAの蓄積により、他因子の液胞内分解が阻害されるためと考えられ、ストレス適応にRny1pが必要であることの一端を示すものです。
Rny1pは、ストレス条件下では液胞に局在しますが、栄養条件下では、細胞外に分泌され、細胞壁に結合します。一方、Rny1pのC末端には特徴的な領域が存在しますが、その役割は不明でした。本研究において、このC末端領域を介して、Rny1pが細胞壁に結合することが示されました。さらに、タンパク質の立体構造予測AIであるAlphaFold2(注6)を用いてRny1pの立体構造を予測し、このC末端構造に類似する既知の構造を探索したところ、糖結合タンパク質が複数見つかりました。ここから、Rny1pはC末端領域を用いて細胞壁の糖鎖に結合することが示唆されました。RNase T2は、さまざまな生物種において多様かつ重要な生命現象にかかわります。そこで、各生物種RNase T2のC末端アミノ酸配列を比較したところ、配列の多様性が見出され、AlphaFold2による構造予測から、それぞれの機能に見合った、固有の構造を取ることが示唆されました(図2)。すなわち、このC末端の多様性が、RNase T2が多岐にわたる役割を果たし得る原因のひとつと考えられます。
ストレス下において、リボソームは、ストレスに応答する因子を翻訳する必要があります。そうした時、全てのリボソームを区別なく分解することは、ストレス応答の面からは非効率です。その意味で、リボソームを選択的に分解することは合理的であると考えられます。本研究は、細胞のストレス応答に対して新たな視点を提供するものです。また、リボソームの機能不全は「リボソーム病」と呼ばれる疾病の原因ともなります。本研究で示した分解対象リボソームの選択性についてさらに研究を深めることで、「リボソーム病」に対する理解、および対処法の考案に結びつくことが期待されます。
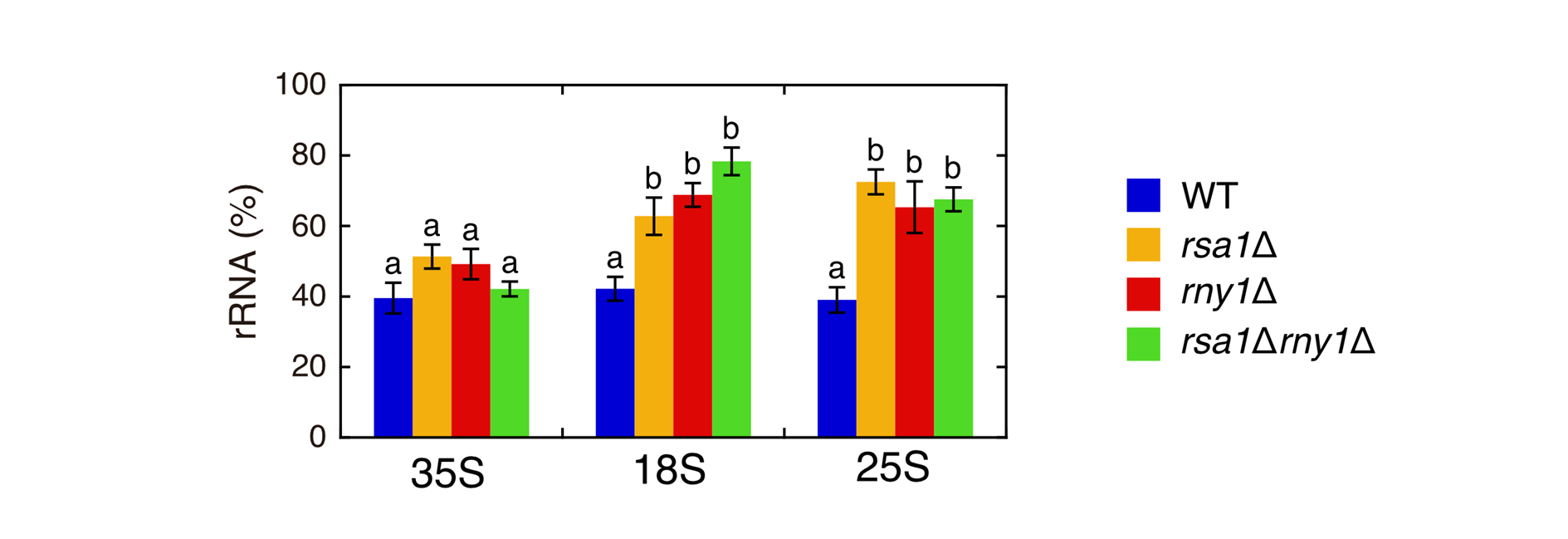
図1:Rsa1pの遺伝子欠損株では窒素源飢餓によるrRNA分解が抑制される
野生株、Rsa1p遺伝子欠損株(rsa1∆)、およびRny1p遺伝子欠損株(rny1∆)に対して窒素源飢餓を誘導した後、細胞内の未分解rRNAを定量した。
rsa1∆株内では、rny1∆株と同等に未分解rRNAがみられた(棒グラフ上の文字が異なる場合、値が有意に異なることを示す)。
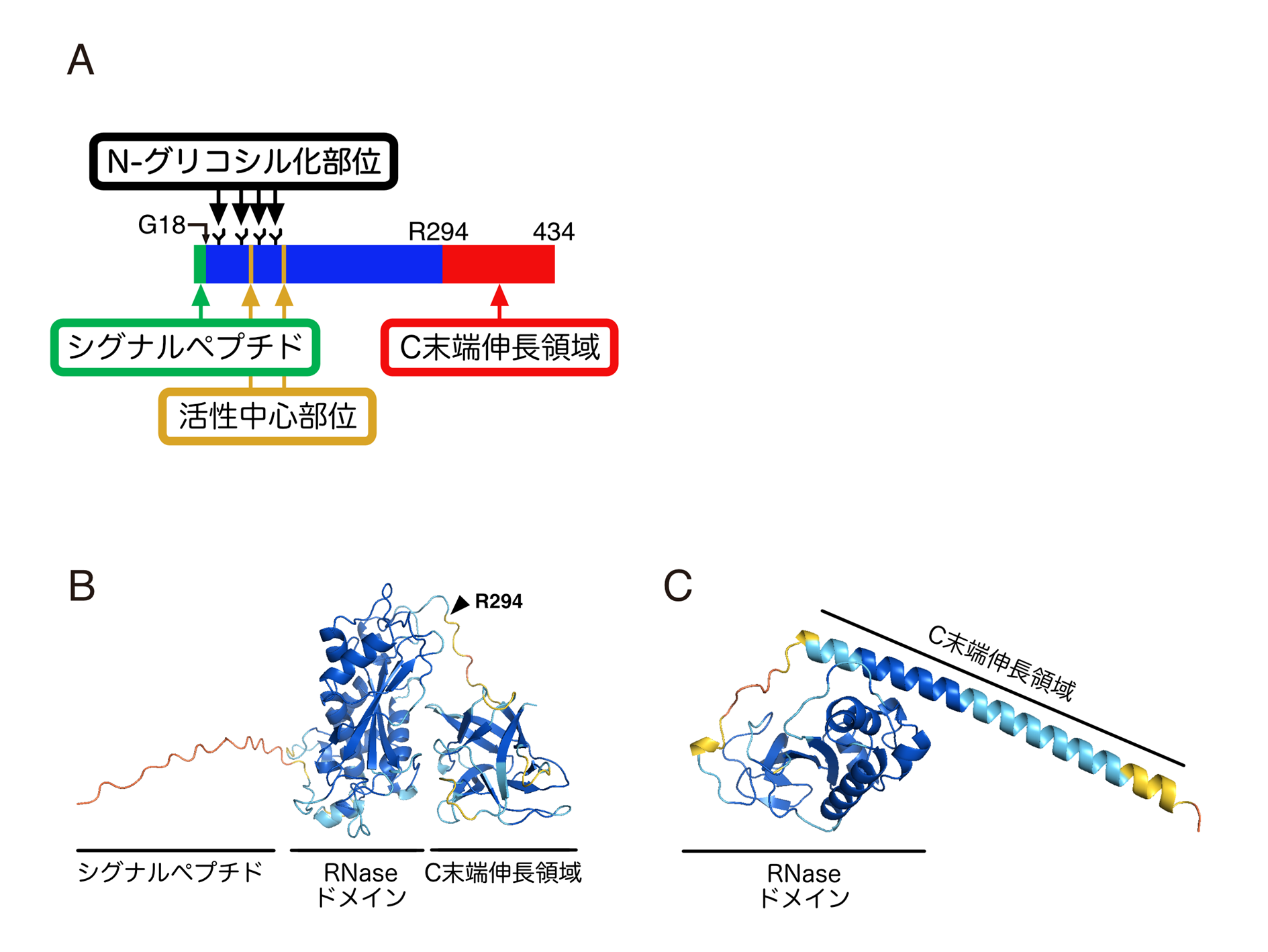
図2:RNase T2のC末端領域は多様性を示す
(A)Rny1pの構造を模式的に示した。Rny1pには特徴的なC末端伸長領域が存在する。(B)Rny1pの立体構造を、AlphaFold2を用いて予測した。
このC末端伸長領域は、RNaseドメインと独立しており、立体構造比較から、糖鎖結合タンパク質と高い構造類似性がみられる。
(C)豚熱ウイルス(classical swine fever (CSF) virus)にも、C末端伸長領域をもつRNase T2が存在する。この立体構造を、(B)と同様に予測したところ、
Rny1pとはまったく異なる予測構造が得られた。
RNase T2のC末端構造多様性により、RNase T2が各生物種に固有の多岐にわたる役割を発揮することが示唆された。
発表者・研究者等情報
東京大学 大学院農学生命科学研究科 応用生命工学専攻
南 篤 博士課程(当時)
現:早稲田大学理工学術院 次席研究員(研究院講師)
西 晃平 修士課程(当時)
山田 陸翠 修士課程(当時)
陣内 凱 修士課程(当時)
島 日佳理 修士課程(当時)
大石 早希子 修士課程(当時)
赤川 博文 修士課程(当時)
青野 俊裕 講師(当時)
現:国立研究開発法人農業・食品産業技術総合研究機構 研究員
日髙 真誠 准教授(当時)
正木 春彦 教授(当時)
現:東京大学名誉教授
葛山 智久 教授
野田 陽一 特任准教授
小川 哲弘 助教
論文情報
雑誌名:Journal of Biological Chemistry
題 名:The ribonuclease RNase T2 mediates selective autophagy of ribosomes induced by starvation in Saccharomyces cerevisiae
著者名:Atsushi Minami†, Kohei Nishi†, Rikusui Yamada†, Gai Jinnai, Hikari Shima, Sakiko Oishi, Hirofumi Akagawa, Toshihiro Aono, Makoto Hidaka, Haruhiko Masaki, Tomohisa Kuzuyama, Yoichi Noda, Tetsuhiro Ogawa*(†: 同等貢献者、*: 責任著者)
DOI: 10.1016/j.jbc.2025.108554
URL: https://doi.org/10.1016/j.jbc.2025.108554
研究助成
本研究は、科研費「25450093、16K07657、20K21266、21K18229、23H02122」およびJST次世代研究者挑戦的研究プログラム「MJSP2108」の支援により実施されました。
用語解説
(注1)出芽酵母
学名Saccharomyces cerevisiae。古くからパンや酒などの製造に利用されてきた、身近な単細胞の真核生物である。細胞の構造や機能がヒトなどと共通する部分が多く、遺伝子操作も容易なため、生命科学の研究でよく用いられるモデル生物のひとつである。
(注2)リボソーム
細胞内でのタンパク質の合成を担う、主要な細胞内小器官である。細胞内に膨大な量存在し、細胞体積の40%程度を占めると試算される。リボソームはタンパク質とrRNAから構成される巨大な複合体であり、大小2つのサブユニットに分かれる。
(注3)RNase T2
江上不二夫博士によって麹菌から発見された、日本発のリボヌクレアーゼである。ほぼ全ての生物に存在し、一本鎖RNAを塩基非特異的に分解する活性を持つ。ヒトでは癌抑制因子として同定され、その後、自然免疫機能の制御に関わることが分かった。また、植物では受粉における自家不和合性への関与、ウイルスでは感染した宿主細胞の免疫システムの攻撃、細菌ではバイオフィルム形成制御など、種によって多様かつ重要な役割を果たす。
(注4)オートファジー
真核生物に保存された、細胞内の構成成分を分解・リサイクルする機構。分解対象の細胞内成分を膜で囲い込み、液胞に輸送して分解する。オートファジーの破綻は、神経変性疾患や癌、加齢に伴う病気など、さまざまな疾患を誘導する。この機構を発見した大隅良典博士(東京科学大学栄誉教授)には、2016年にノーベル生理学・医学賞が授与された。
(注5)液胞
出芽酵母をはじめとする真菌や植物細胞に存在する大きな細胞内小器官で、動物細胞のリソソームに相当する。水分の貯蔵、老廃物の隔離、消化酵素による細胞内物質の分解などを担う。
(注6)AlphaFold2
米国Alphabet社傘下のGoogle DeepMind社が開発した、タンパク質の立体構造を高精度に予測する人工知能モデル。開発者のJohn Jumper博士とDemis Hassabis博士には、2024年にノーベル化学賞が授与された。
問合せ先
(研究内容については発表者にお問合せください)
東京大学大学院農学生命科学研究科 応用生命工学専攻
助教 小川 哲弘(おがわ てつひろ)
Tel:03-5841-3079 E-mail:atetsu [at] g.ecc.u-tokyo.ac.jp
[at] は @ に変換してください。