抗生物質の構造多様性構築に重要な生合成酵素反応の分子基盤を解明 ――酵素反応選択性の構造基盤の解明と人工制御――
発表のポイント
- 強力な活性を示すリンコサミド抗生物質の部分構造の作り分けに重要な生合成酵素の構造機能の解明と、非天然型新規化合物の創出に成功しました。
- 2種類の酵素が触媒する反応を実験化学と計算化学の両方から精査することにより、本酵素群が触媒するユニークな化学反応のメカニズムを解明しました。
- 今後、酵素の機能を改変して有用物質生産へ応用することで、新たな創薬シード化合物の創出など、薬科学の発展への貢献が期待されます。
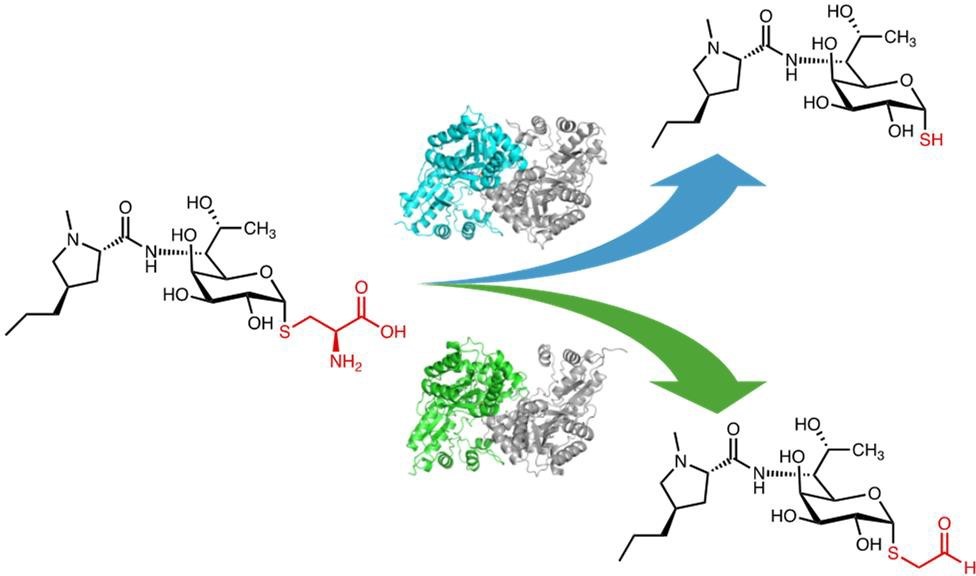
リンコサミド類生合成における構造多様性構築の鍵反応
概要
東京大学大学院薬学系研究科の森貴裕准教授、阿部郁朗教授と、大学院農学生命科学研究科の寺田透教授、森脇由隆助教(現、東京科学大学 准教授)、チェコ科学アカデミー微生物研究所のJiri Janata教授、Zdenek Kamenik教授らによる研究グループは、抗生物質として利用されるリンコサミド化合物の生合成中、構造多様性構築の鍵酵素であるピリドキサール5'-リン酸(PLP)依存性酵素の立体構造解析、および計算化学から、触媒反応選択性の構造基盤を解明しました。さらに、構造を基にして合理的に酵素活性部位に変異を導入することで、酵素触媒反応選択性を人為的に制御することにも成功しました。今後、多様なPLP依存性酵素の構造機能解析を行い、触媒反応選択性の構造基盤を明らかとしていくことで、PLP依存性酵素の触媒機能の人工制御や、生体触媒にも利用可能な有用酵素の創出など、薬科学の発展への貢献が期待されます。
発表内容
リンコサミド類は、放線菌から発見された抗菌活性を持つ化合物群であり、リンコマイシンA やその合成誘導体であるクリンダマイシンは臨床利用もされている天然由来の化合物です。本化合物群は、原核生物(注5)のリボソーム 50S サブユニット(注6)へ結合し、ペプチド鎖が伸長する際にペプチド転移反応を阻害し抗菌活性を示します。リンコサミド類の化学構造は、硫黄原子を糖の構造内に含む、特徴的なチオオクトース部位とアルキル化されたプロリン部位から構成されます(図1)。過去の構造活性相関研究(注7)から、硫黄原子の修飾の違いが生物活性の選択性や強度に重要であることが明らかとされていました。リンコマイシン A やその類縁体セレスチセチンの生合成において、硫黄原子の構造多様性は PLP 依存性酵素 LmbFと CcbF の酵素反応によって構築されることが知られています。LmbF と CcbF は互いに高いアミノ酸配列類似性を示すにもかかわらず、異なる化学反応を触媒し、硫黄原子部分の構造が異なる生成物を与えます。これまでに、LmbF と CcbF の反応機構の解析は行われておらず、酵素触媒反応の違いを生み出している要因は不明でした。
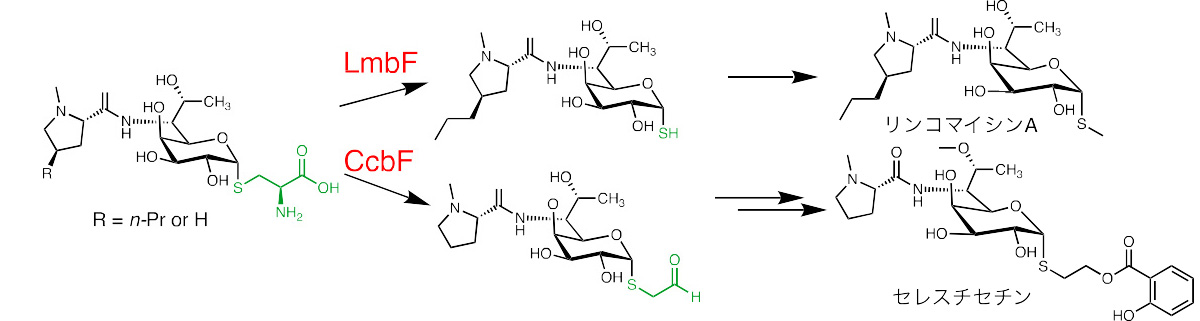
図1 リンコサミド類生合成における生合成分岐反応
研究グループはまず、反応制御機構の構造基盤を解明するため、LmbF とCcbF のX 線結晶 構造解析(注8)を行い、2つの酵素間で基質結合に関わるアミノ酸残基に違いがあることを 見出しました。また、酵素と基質のドッキングシミュレーション(注9)及び、分子動力学計 算(MD シミュレーション)(注10)による酵素反応の動的変化解析を行うことで、LmbF と CcbF が活性部位内においてどのように基質結合と反応選択性を制御しているかの酵素触媒反 応機構の詳細を解明しました。
さらに、得られた構造や触媒反応機構の知見を基に活性部位のアミノ酸残基に対して部位特 異的変異(注11)を導入し、CcbF の反応選択性をLmbF 型の反応選択性へと変換することに 成功しました。また、その過程で、天然では見出されないアミド構造を有する非天然型新規リ ンコサミド誘導体の創出にも成功しました(図2)。
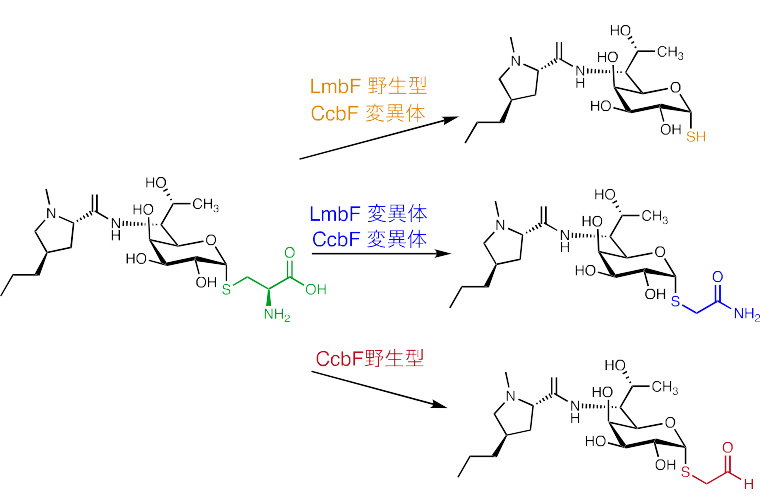
図2 酵素野生型と変異体の生成物の変化
以上、本研究では、放線菌由来のリンコサミド抗生物質の生合成分岐の鍵酵素による、構造多様性構築機構を世界に先駆けて明らかにしました。さらに、酵素の機能を改変することで、非天然型新規化合物の創出にも成功しました。今後、さらに酵素の機能を改変して有用物質生産へ応用し、得られた新規化合物の生理活性評価を行なっていくことで、医薬品シード化合物の発見など、生体触媒による創薬研究への応用も期待されます。
発表者・研究者等情報
東京大学
大学院薬学系研究科
阿部 郁朗 教授
森 貴裕 准教授
大学院農学生命科学研究科
寺田 透 教授
森脇 由隆 研究当時:助教
現:東京科学大学 准教授
チェコ科学アカデミー 微生物研究所
Jiri Janata 教授
Zdenek Kamenik 教授大学院農学生命科学研究科 応用生命工学専攻
論文情報
- 雑誌
- Nature Chemistry
- 題名
- Molecular basis for the diversification of lincosamide biosynthesis by pyridoxal phosphate dependent enzymes
- 著者
- Takahiro Mori*, Yoshitaka Moriwaki*, Kosuke Sakurada, Shuang Lyu, Stanislav Kadlcik, Jiri Janata, Aninda Mazumdar, Markéta Koberska, Tohru Terada*, Zdenek Kamenik*, and Ikuro Abe*
- DOI
- 10.1038/s41557-024-01687-7
- URL
- https://www.nature.com/articles/s41557-024-01687-7
論文情報
本研究は、科研費(JP20H00490、JP22H05126、JP23H00393、JP23H02641)、国立研究開発法人 日本医療研究開発機構(AMED) 創薬基盤推進研究事業 生物資源利活用研究分野 (JP21ak0101164、JP23ama121027)、国立研究開発法人 新エネルギー・産業技術総合開発機構 (NEDO:JPNP20011)、科学技術振興機構(JST)さきがけ(JPMJPR20DA)の支援により実施 されました。
用語解説
- 注1 抗生物質
微生物や細胞に作用してその生育などを抑制、阻害する作用を持つ物質のことです。細菌感染症に効果があります。 - 注2 ピリドキサール 5'-リン酸(PLP)依存性酵素
PLP とは、酵素の補欠分子族の 1 つで、ビタミン B6 の活性型です。PLP 依存性酵素では、活性部位内において PLP と基質が縮合し、電子移動を介した反応により、アミノ基含有基質に対して幅広い化学反応が触媒されます。 - 注3 触媒反応
特定の化学反応の反応速度を速める物質で、自身は反応の前後で変化しないものを触媒といいます。今回の場合は、酵素が触媒であり、触媒の作用によって進行する反応を触媒反応と呼びます。 - 注4 酵素活性部位
酵素が反応を行う場のことです。通常、タンパク質のアミノ酸残基で構成され、この部分に基質が結合することで化学反応が触媒されます。 - 注5 原核生物
単細胞で細胞内に DNA を包む細胞核を持たない生物の名称です。対をなす生物として細胞核を持つ真核生物がいます。 - 注6 リボソーム 50S サブユニット
生体反応の中心因子であるタンパク質の多くは、他のタンパク質と複合体を形成し、マルチサ ブユニット複合体として存在します。タンパク質合成はリボソームという器官で行われ、細菌 のリボソームは 30S と 50S という 2 つのサブユニットに分けられます。リンコマイシン系抗生 物質はそれらのうち、特に 50S のサブユニットに作用して抗菌活性を示します。 - 注7 構造活性相関研究
化学物質の構造と生物活性との関係を明らかにする研究のことです。化学物質の構造をさまざ まに変換して生物活性を評価することでどの部分が生物活性に重要かを調べます。これにより 構造的に類似した化合物の薬効について予測することが可能となります。 - 注8 X 線結晶構造解析
物質の 3 次元構造を知る手法の 1 つです。酵素タンパクなどを結晶化し、散乱された X 線を観 測することで、物質の中の電子の分布を知ることができます。 - 注9 ドッキングシミュレーション
低分子と生体高分子が相互作用した複合体の安定構造をコンピュータ上で計算的に推定する手 法のことです。 - 注10 分子動力学計算(MD シミュレーション)
物質を構成する原子 1 つ 1 つに対して、古典力学における Newton の運動方程式を解き、原子 位置やエネルギーの時間変化を追跡する手法です。酵素や反応中間体構造の動的変化のシミュ レーションに用いられます。 - 注11 部位特異的変異
酵素のアミノ酸配列の特異的な部位に変異を導入し、変異させたアミノ酸の役割を解析する手 法です。
研究資金
本研究の一部は、(独)環境再生保全機構の環境研究総合推進費(JPMEERF20194007、JPMEERF20221C01)、(独)日本学術振興会(JSPS)の科研費(19K12310、20H03077、20H00653)、国立研究開発法人産業技術総合研究所・環境調和型産業技術研究ラボ(E-code)、総合地球環境学研究所のLINKAGEプロジェクト、国立研究開発法人 新エネルギー・産業技術総合開発機構(NEDO)の支援を受けて実施しました。
問い合わせ先
(研究内容については発表者にお問合せください)
東京大学大学院薬学系研究科
教授 阿部 郁朗(あべ いくろう)
E-mail:abei[at]mol.f.u-tokyo.ac.jp
東京大学大学院農学生命科学研究科 応用生命工学専攻
教授 寺田 透(てらだ とおる)
E-mail:tterada[at]bi.a.u-tokyo.ac.jp
東京大学大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)
TEL:03-5841-8179,5484
E-mail:koho.a[at]gs.mail.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。

