アザセリンの生合成経路の解明:亜硝酸非依存型ジアゾ基合成経路の発見
- 発表者
- 四海 佑亮 (東京大学大学院農学生命科学研究科 応用生命工学専攻 修士課程2年、
プロアクティブ環境学国際卓越大学院プログラム第8期生)
川合 誠司 (東京大学大学院農学生命科学研究科 応用生命工学専攻 博士課程2年、日本学術振興会特別研究員DC1)
勝山 陽平 (東京大学大学院農学生命科学研究科 応用生命工学専攻 准教授)
大西 康夫 (東京大学大学院農学生命科学研究科 応用生命工学専攻 教授)
発表のポイント
- 抗腫瘍活性及び抗菌活性を有するジアゾ基含有アミノ酸、アザセリンの生合成経路が解明されました。
- ヘテロ環化(Cy)ドメインを有する非リボソームペプチド合成酵素AzsOがアザセリンのエステル結合の形成を触媒することが示されました。
- アザセリンに存在するジアゾ基が窒素–窒素結合の段階的な酸化によって形成されることが示されました。
発表概要
アザセリンは放線菌 (注_1) によって生産されるジアゾ基 (注_2) を有するアミノ酸の一種です。発表者らはアザセリンを生産すると報告のある放線菌のゲノムデータの解析、予想生合成遺伝子クラスターの異種発現と組換えタンパク質を用いた試験管内実験から、アザセリン生合成経路の全容を明らかにしました。本研究によって、アザセリンの持つジアゾ基がこれまでに報告のない窒素–窒素結合の段階的な酸化によって形成されることを示すことができました。また、アザセリンのエステル結合の形成はヘテロ環化(Cy)ドメインを有する非リボソームペプチド合成酵素 (注_3) AzsOによって触媒されることを明らかにしましたが、これはエステル結合形成を触媒するCyドメインの最初の報告となりました。
※本研究論文は、掲載誌においてHOT Articleに選出されるとともにInside front coverに採用されました。
発表内容
生物はその生育に必須な一次代謝の他に、生育に必須ではない二次代謝を行うことがあります。この二次代謝により生み出される二次代謝産物は医薬品や農薬などの形で人類社会に役立てられており、特に放線菌が生産する二次代謝産物は抗生物質や抗ガン剤などの医薬品に幅広く利用されています。また、二次代謝産物はユニークで複雑な化学構造を有することも多く、創薬分野において新規医薬品のリード化合物として利用されているほか、その複雑な化学構造を生み出す生合成酵素にも注目が集まっています。
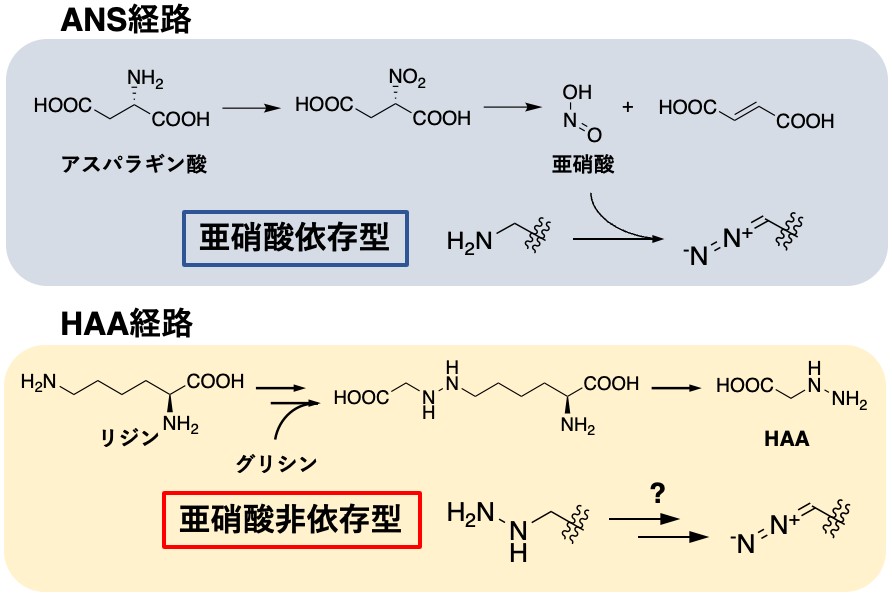
ジアゾ基をはじめとする窒素–窒素 (N–N) 結合を有する化合物は、天然から約200種類程度報告されています。発表者が所属する醗酵学研究室では、ジアゾ基を有する芳香族化合物であるクレメオマイシンの生合成研究から、様々な放線菌に保存されている二次代謝用の亜硝酸生合成経路を見出していました (図1)1。 ANS経路と命名された本経路は2つの酵素からなり、L-アスパラギン酸から亜硝酸を合成します。この経路により作られる亜硝酸は、ジアゾ基をはじめとする複数のN–N結合を有する天然物の生合成に利用されることが近年報告されています。その一方で、亜硝酸を利用しないジアゾ基の生合成はこれまで報告がありませんでした。
亜硝酸を利用しないN–N結合の生合成は複数報告があり、その中の一つにヒドラジノ酢酸 (HAA) の生合成があります (図2)。HAAはL-リジンとグリシンを基質として3つの酵素で合成されるN–N 結合を有する化合物です。その生合成機構は、化合物s56-p1の前駆体として、本研究科の細胞機能工学研究室によって報告されました2。この3つの遺伝子からなるHAA生合成遺伝子群は様々な二次代謝産物生合成遺伝子群に保存されています。
発表者らはジアゾ基を有するアミノ酸であるアザセリンに着目し、その生合成機構の解析を試みました。アザセリンは抗腫瘍活性及び抗菌活性を有する化合物であり、グルタミンとの構造類似性からグルタミン代謝の競合阻害剤として作用します。その有用な生理活性から、医学分野での研究において利用されてきました。また、ラットにおけるがんの誘引剤として現在でも広く利用されています。
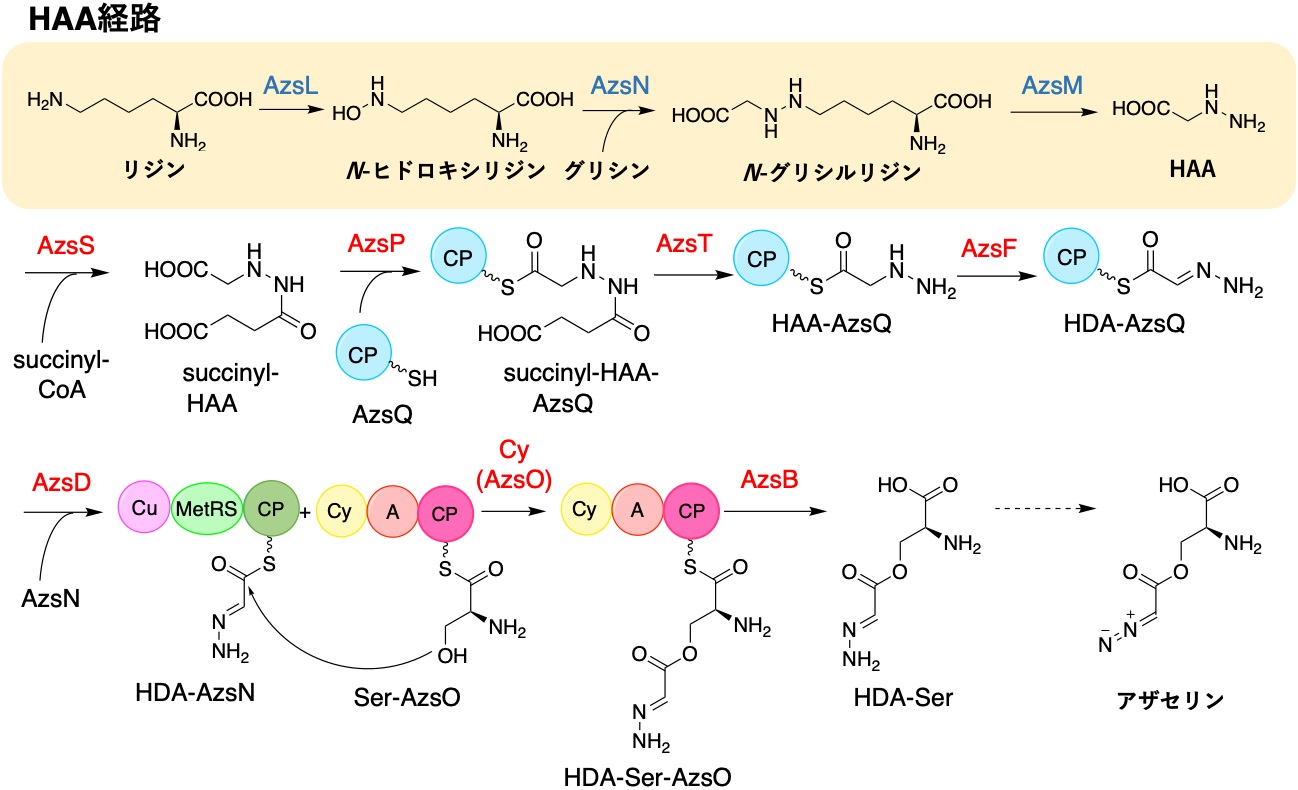
まず、発表者らはアザセリンを生産することが知られている放線菌Streptomyces fragilisとGlycomyces harbinensisのゲノムを比較することでazaserine生合成遺伝子クラスターの探索を試みました。ジアゾ基の生合成に用いられることが知られているANS経路の遺伝子がこれらの株に存在しなかったことから、アザセリンのジアゾ基が亜硝酸由来ではなく、HAAの段階的な酸化により形成されると予想しました (図1)。この予想に基づいて、HAA生合成遺伝子 (azsL、azsM、azsN) を含む、両株に保存された遺伝子クラスターを見出し、これがアザセリンの生合成遺伝子クラスター (azsクラスター) であると推定しました。
次に、S. fragilisに存在するazsクラスターの全長を挿入したベクターと、そのazsクラスター内に存在する、LuxRファミリー転写制御因子をコードする遺伝子azsRの上流にtipAプロモーターを配置したベクターを放線菌Streptomyces albusに導入し、異種発現による代謝解析を行いました。その結果、アザセリンの生産が確認されました。このことから、azsクラスターがアザセリンの生産を担うことが示されました。
続いて、azsクラスター内の遺伝子 (azsB、azsD、azsF、azsO、azsP、azsQ、azsS、azsT) を大腸菌に導入し、組換えタンパク質を生産・精製しました。また、反応解析のためAzsO及びAzsNのC末端に存在するキャリアータンパク質 (CP) ドメインだけからなる組換えタンパク質も同様に取得し、それらの酵素を用いて試験管内反応を解析しました。その結果、これらの酵素の機能の同定に成功し、アザセリン生合成経路が以下のように明らかになりました (図2)。まず、AzsSによりHAAからスクシニルHAAが合成されます。その後AzsPによりスクシニルHAAがCPであるAzsQにロードされます。こうして合成されたスクシニルHAA-AzsQはAzsTにより脱スクシニル化され、HAA-AzsQへと変換されます。HAA-AzsQはAzsFにより脱水素化されHydrazineylideneacetyl-AzsQ (HDA-AzsQ) が合成されます。HDA-AzsQはAzsDによりAzsNのC末端に存在するCPドメインに転移されます。その後AzsOのCyドメインによって、AzsOのCPドメインに結合したL-セリンの水酸基とAzsN上のHDAがエステル結合を形成しHDA-Ser-AzsO-CPを合成します。HDA-Ser-AzsO-CPはAzsBによって加水分解され、HDA-Serが生成します。最後に何かしらの酸化酵素が作用してアザセリンが合成されると予想しています。
続いて、AzsOのCyドメインに着目し、一連の反応に重要と思われるいくつかのアミノ酸残基を別のアミノ酸で置換しました。まず、ペプチド結合形成に関与するDxxxxDモチーフのD193及びD198をアラニンに置換しました。また、Cyドメインの環化反応に重要であるとされるスレオニンとアスパラギン酸の二つのアミノ酸残基はどちらもアスパラギンになっていたので、その二つの残基N414及びN447をアラニン置換すると同時に、それぞれスレオニンとアスパラギン酸にも置換しました。これらの変異体酵素について酵素反応解析を行ったところ、すべての変異体酵素でエステル結合形成の反応は消失し、新たな反応の進行も見られませんでした。このことから、これらのアミノ酸残基はエステル結合形成において重要であることが示されました。
本研究により、亜硝酸非依存的に形成されるジアゾ基を含むアミノ酸の生合成機構が明らかになりました。ジアゾ基の形成がN–N結合の段階的な酸化によって形成されることを示した意義はとても大きいです。また、エステル結合形成を触媒するCyドメインの発見も非常に興味深いといえます。
ゲノムデータベースにはアザセリンの生合成遺伝子クラスターと類似した生合成遺伝子クラスターが複数存在し、亜硝酸非依存的にジアゾ基を持つ化合物を作る微生物が他にも存在することが示唆されました。そのため、これらの菌について解析を進めることで、新たなジアゾ基含有化合物の発見につながると考えられます。本研究は放線菌の二次代謝に関する知識を深めると同時に、新規医薬品開発に貢献することが期待されます。
参考文献
- Sugai, Y., Katsuyama, Y., & Ohnishi, Y. (2016). A nitrous acid biosynthetic pathway for diazo group formation in bacteria. Nature chemical biology, 12(2), 73-75.
- Matsuda K., Tomita T., Shin-ya K., Wakimoto T., Kuzuyama T., & Nishiyama M. (2018). Discovery of Unprecedented Hydrazine-Forming Machinery in Bacteria. Journal of the American Chemical Society, 140 (29), 9083-9086
発表雑誌
- 雑誌名
- Chemical Science
- 論文タイトル
- In vitro characterization of nonribosomal peptide synthetase-dependent O-(2-hydrazineylideneacetyl)serine synthesis indicates a stepwise oxidation strategy to generate the α-diazo ester moiety of azaserine
- 著者
- Yusuke Shikai, Seiji Kawai, Yohei Katsuyama, and Yasuo Ohnishi
- DOI番号
- 10.1039/D3SC01906C
- Inside front coverURL
- https://pubs.rsc.org/en/content/articlepdf/2023/sc/d3sc90160b?page=search
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 醗酵学研究室
准教授 勝山 陽平(かつやま ようへい)
Tel:03-5841-5124
Fax:03-5841-8021
研究室URL:http://park.itc.u-tokyo.ac.jp/hakko/
E-mail:aykatsuhko<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 放線菌
原核生物の一群で、その多くが菌糸を放射状に伸長させて増殖することから名付けられた。生活環において様々な形態を示すことから、最も形態分化が進んだバクテリアとして知られている。ゲノムサイズが非常に大きく、生命維持に必須ではない二次代謝に関与する遺伝子も多く有している。抗生物質を始めとする様々な治療薬を生産することから、創薬の観点からも重要な微生物として知られている。 - 注2 ジアゾ基
窒素原子2つからなる官能基(=N+=N-)。反応性が高く、様々な有機化学反応の足場として用いられる。また、ジアゾ基を有する二次代謝産物の多くが有用な生物活性を持つことで知られている。 - 注3 非リボソームペプチド合成酵素
二次代謝を担う酵素の一種であり、一般にアミノ酸の縮合によるペプチド鎖の形成を触媒する。こうして形成される二次代謝産物は非リボソームペプチドと呼ばれる。アミノ酸の縮合を触媒する縮合 (C) ドメイン、キャリアータンパク質 (CP) ドメインにアミノ酸をロードするアデニル化 (A) ドメイン、アミノ酸やペプチド鎖の足場となるCPドメインで構成される場合が多い。AzsOはCドメインの代わりに、一般にヘテロ環化を伴うアミノ酸の縮合を触媒するヘテロ環化 (Cy) ドメインで構成されている。