尿酸降下薬アロプリノールの作用機序の詳細が明らかに ――副作用の少ない新たな投与計画の最適化に期待――
発表のポイント
- 尿酸降下薬アロプリノールの主代謝物であるオキシプリノールのキサンチン酸化還元酵素(XOR)阻害機構を詳細に解明しました。
- アロプリノールとオキシプリノールのXOR阻害機構及びその効力には大きな違いがあることを明らかにしました。
- アロプリノール投与方法の最適化による尿酸生成抑制効果の向上と副作用軽減に貢献することが期待されます。
発表概要
尿酸降下薬アロプリノール(注1)とその代謝物であるオキシプリノール(注2)のキサンチン酸化還元酵素(XOR)(注3)阻害機構及び効力に大きな違いがあることを見出し、“アロプリノールの尿酸降下作用の主体はオキシプリノールである”という従来の定説が誤っていることを明らかにしました。これにより、高尿酸血症・痛風患者へのより適切な尿酸降下療法の提供が期待されます。
発表内容
〈研究の背景〉
キサンチン酸化還元酵素(XOR)阻害薬であるアロプリノールは半世紀以上の使用実績があり、より強い阻害効果をもつフェブキソスタット(注4)、トピロキソスタット(注5)が登場した現在でも世界中で広く使用されています。アロプリノールは比較的安全性の高い薬ですが、腎排泄性であることから腎機能障害では減量が必要となるなど、現在でもその有効な投与量について議論されています。開発当初は2〜3回に分けての服用が推奨されていましたが、最近では単回投与の使用もみられ、フェブキソスタットとの臨床比較試験においても、比較が容易であることから単回投与が選択されています。このような投与法の背景には、アロプリノールの主代謝物であるオキシプリノールがXOR阻害のエフェクターであり、アロプリノールと同等の阻害効果を発揮するという仮定があります。オキシプリノールは血中半減期が18〜30時間と長く、アロプリノール(血中半減期1〜2時間)に比べて血中に蓄積しやすいことから、尿酸降下効果の主体であると考えられています。しかし、明確な根拠は提示されていません。また、欧米諸国では多くの患者が目標血清尿酸値を達成できず800-900 mgまで用量を増やすことが承認されており、これによりスティーブンス・ジョンソン症候群などの重篤な副作用のリスクが懸念されています。副作用の発現にはオキシプリノールの関与が示唆されています。
〈研究の内容〉
本研究メンバーはこれまで高尿酸血症・痛風治療薬の標的であるXORの反応機構解析、その阻害薬であるフェブキソスタット、トピロキソスタットの阻害機構解析により、認可・使用までの橋渡し研究を行なってきました(1-4)。そこで得た知見を生かし、高尿酸血症モデルマウス及び新鮮な牛乳(日本獣医生命科学大学付属 富士アニマルファームより提供)から精製したXORを用いた詳細な阻害解析により、今回オキシプリノールの機構解明に取り組みました。 オキシプリノールを高尿酸血症モデルマウスに直接投与すると、アロプリノールよりも弱い尿酸降下作用が得られます。XORが触媒するアロプリノールからオキシプリノールへの反応は、酵素活性部位でのオキシプリノールの回転とモリブデンMo(VI)活性中心のMo(IV)への還元をもたらし、強固な配位結合の形成と尿酸生成抑制効果をもたらします(図1A)。私たちはオキシプリノールの尿酸降下作用の速度論的解析と構造解析を行い、Mo(VI)へ再酸化されるとオキシプリノールの結合は大きく弱まり(図1B)、阻害剤-酵素複合体の再構築にはヒポキサンチン、キサンチン、アロプリノールによる還元が必要であることを示しました。
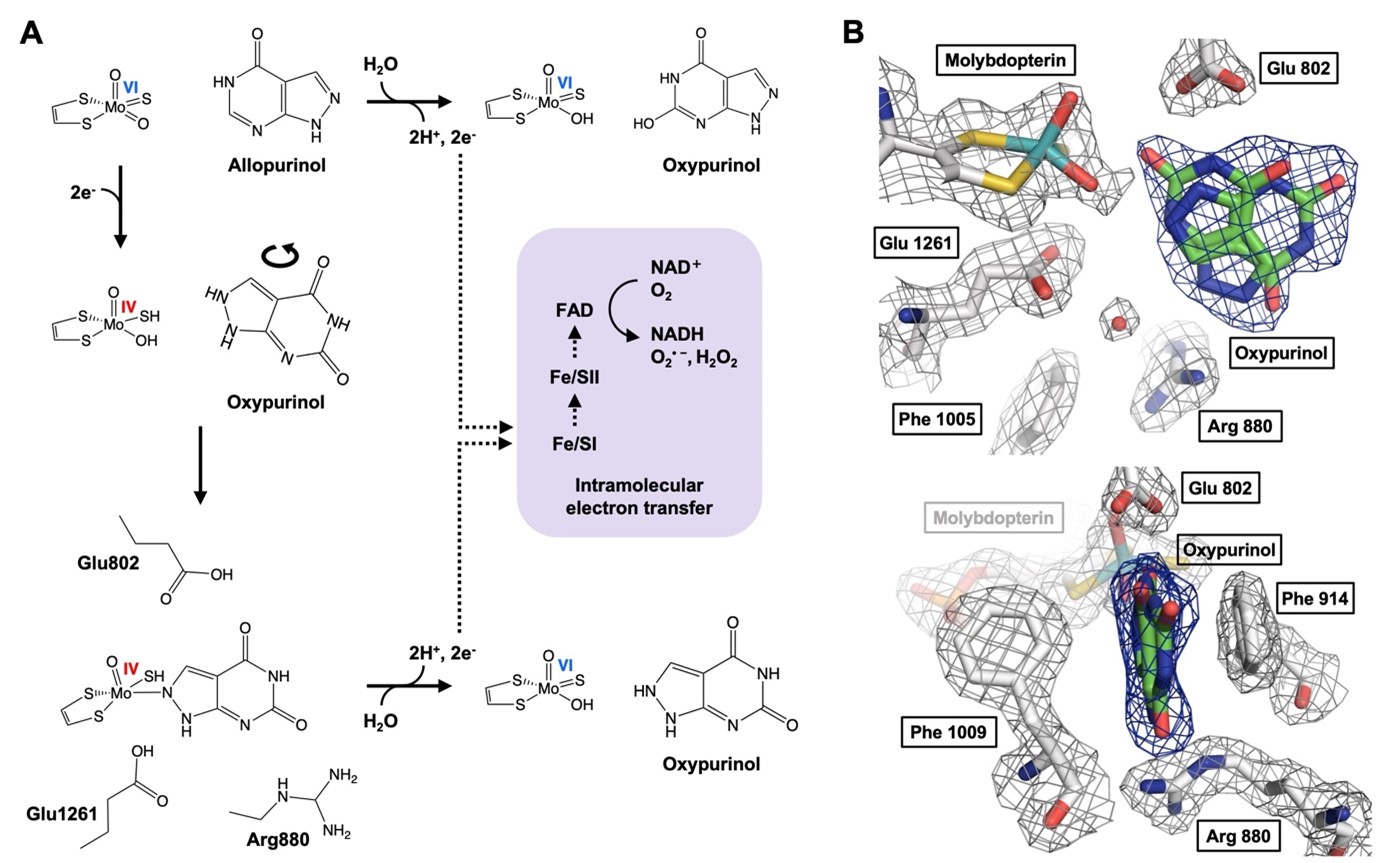
図1:アロプリノールのXOR阻害機構(A)と酸化型XOR-オキシプリノール複合体サブユニットAの活性部位の結晶構造(B)
(A)アロプリノールはXORのモリブデン中心でオキシプリノールに変換され、水分子から酸素を受け取る(上)。電子は2つの鉄硫黄クラスターを経由してFADに渡り、NAD+ (XDH)またはO2 (XO)を還元する。反応の過程でモリブデンは、基質としてのプリン、すなわちアロプリノール(中)から電子を受け取ることによって、Mo(VI)からMo(IV)に還元される。こうして形成されたMo(IV)は一過性にしか生じないが、オキシプリノールが適切に配向すると、阻害剤-酵素複合体を形成する(下)。還元型XOR-オキシプリノール複合体は徐々に再酸化され、オキシプリノールは解離する。
(B)遊離のオキシプリノールはモリブデンと明確な結合を示さず、その阻害効果は著しく減弱する。再結合には他の基質(ヒポキサンチン、キサンチン、アロプリノール)が必要である。
また、XORが触媒する二段階反応(ヒポキサンチン→キサンチン→尿酸)に対し、オキシプリノールはヒポキサンチンからキサンチンへの変換を弱く阻害するだけで、プリン新規合成をフィードバック阻害する可能性が低いことが示されました(図2)。さらに、オキシプリノールによるプリンヌクレオシドホスホリラーゼ(PNP)の弱いアロステリック阻害が観察されました。PNPの欠損は主にT細胞の機能障害を通して免疫不全を誘発することがわかっています。
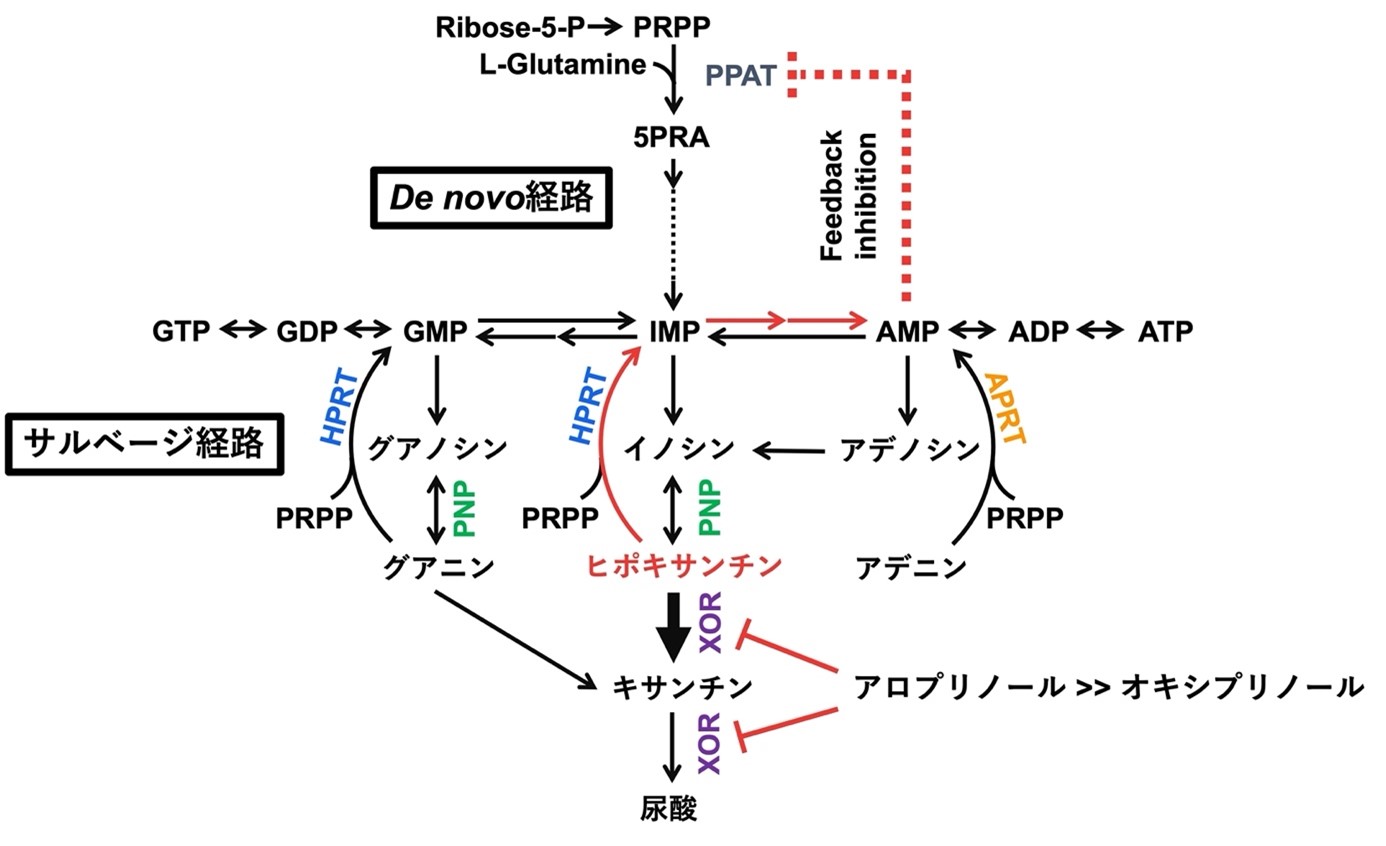
図2:XOR阻害がプリン代謝に与える影響
尿酸はXORが触媒する二段階反応(ヒポキサンチンからキサンチン, キサンチンから尿酸)によって生成され、ヒポキサンチンの方がXORの基質として優れている。アロプリノールはヒポキサンチンからキサンチンへの変換を阻害でき、ヒポキサンチンを蓄積させる。ヒポキサンチンはヒポキサンチンホスホリボシルトランスフェラーゼ(HPRT)が触媒するサルベージ経路を介してde novo経路の律速酵素であるホスホリボシルピロリン酸アミドトランスフェラーゼ(PPAT)を阻害し、プリン体合成を抑制する。したがって、尿酸を効果的に低下させるにはヒポキサンチンからキサンチンへの段階を強く阻害することが不可欠であるが、XORから遊離したオキシプリノールはこの段階に対する阻害が極めて弱い。
〈今後の展望〉
これらの結果より、単回投与法では十分な血清尿酸値低下作用を得るためにアロプリノール投与量を増やす必要があり、過剰投与になりやすいということが示唆されました。ヒポキサンチンからの二段階反応を効果的に阻害するためには、少量のアロプリノールを複数回投与することがより効果的であると考えられます。阻害剤-酵素複合体の半減期を考慮すると、このような分割投与は、血清尿酸値を低下させるのに必要なアロプリノールの総量を減少させると同時に、血中オキシプリノールの蓄積を最小限に抑え、副作用のリスクを減少させることが期待されます。
発表者
関根 舞(東京大学大学院農学生命科学研究科 博士課程:当時、現在・東京薬科大学 助教)
岡本 研(東京大学大学院農学生命科学研究科 特任研究員)
Emil F. Pai(トロント大学 名誉教授)
永田 宏次(東京大学大学院農学生命科学研究科 教授)
市田 公美(東京薬科大学大学薬学部 教授:当時)
Russ Hille(カリフォルニア大学リバーサイド校 教授)
西野 武士(東京大学大学院農学生命科学研究科特任教授:当時、日本医科大学 名誉教授)
発表雑誌
- 雑誌
- Journal of Biological Chemistry
- 題名
- Allopurinol and oxypurinol differ in their strength and mechanisms of inhibition of xanthine oxidoreductase
- 著者
- Mai Sekine, Ken Okamoto, Emil F. Pai, Koji Nagata, Kimiyoshi Ichida, Russ Hille, Takeshi Nishino
- DOI
- https://doi.org/10.1016/j.jbc.2023.105189
- URL
- https://www.jbc.org/article/S0021-9258(23)02217-2/fulltext
用語解説
- 注1 アロプリノール
アロプリノールは1960年代に開発され、長年にわたり唯一のXOR阻害薬として使用されてきました。ヒポキサンチンの類似体であるアロプリノールは当初、競合阻害剤として作用すると考えられましたが、XORの酵素自殺基質であるため、その効力は競合阻害剤よりもはるかに強くなります。 - 注2 オキシプリノール
オキシプリノールはアロプリノールの主な代謝物であり、2位の炭素がXORによって水酸化された構造を有します。オキシプリノールはXORの基質とならず、モリブデンを還元することができません。アロプリノールは主に糸球体濾過によって除去されますが、オキシプリノールは尿細管再吸収を受けるため血中濃度が高くなりやすく、副作用の原因となることがあります。 - 注3 キサンチン酸化還元酵素
キサンチン酸化還元酵素(xanthine oxidoreductase; XOR)はプリン代謝の最終段階であるヒポキサンチンからキサンチン、キサンチンから尿酸への反応を触媒する酵素であり、高尿酸血症・痛風治療薬の標的となっています。 - 注4 フェブキソスタット
フェブキソスタットは2011年に日本で承認・発売された非プリン型選択的XOR阻害薬であり、混合型阻害を示します。海外ではアロプリノールとの比較試験が多く実施されています。 - 注5 トピロキソスタット
トピロキソスタットは2013年に日本で承認・発売された非プリン型選択的XOR阻害薬であり、アロプリノールとフェブキソスタット両方の特徴を併せもつハイブリッド型の阻害剤です。
問い合わせ先
〈研究に関する問合せ〉
東京大学大学院農学生命科学研究科 博士課程(当時)
現在:東京薬科大学薬学部 助教
関根 舞(せきね まい)
Tel:042-676-5704 E-mail:sekine[アット]toyaku.ac.jp
東京大学大学院農学生命科学研究科 特任教授(当時)
日本医科大学 名誉教授
西野 武士(にしの たけし)
Tel:03-3947-1150 E-mail:nishino[アット]nms.ac.jp
東京大学大学院農学生命科学研究科応用生命化学専攻食品生物構造学研究室 教授
永田 宏次(ながた こうじ)
Tel:03-5841-1117 E-mail:aknagata[アット]mail.ecc.u-tokyo.ac.jp
※[アット]を@に変えてください。

