結核菌の細胞壁の分解酵素の正体を50年ぶりにつきとめた
発表のポイント
- 結核菌の細胞壁には複雑な多糖D-アラビナンが含まれており、ヒトの免疫システムから逃れるのに使われています。
- D-アラビナンの分解酵素が存在することは1970年代初頭に報告されていましたが、その正体は全く分かっていませんでした。
- D-アラビナンを分解する酵素を4種類発見して、そのうち3種類で詳細な立体構造と分解メカニズムを明らかにしました。
発表概要
結核菌の細胞壁にはリポアラビノマンナンおよびアラビノガラクタンと呼ばれている複合分子が存在しており、その中心部はD-アラビナンという多くの糖が連なった複雑な部分から成り立っています。これらの分子は結核菌とヒトの免疫システムの相互作用に重要な役割を果たしています。1971年に大阪大学のグループが土壌細菌からD-アラビナンを分解する酵素を見つけて報告していますが、その正体はこれまで全く分かっておらず、ほとんど研究が進んでいませんでした。東京大学大学院農学生命科学研究科の伏信進矢教授らのグループは、鹿児島大学、理化学研究所、高エネルギー加速器研究機構などのグループと共同研究を行い、D-アラビナンを様々な方式で分解する酵素を4種類発見し、それらの遺伝子をつきとめました。さらに、そのうち3種類の酵素の立体的なかたちを解明して、これらの酵素がどのようにしてD-アラビナンを分解するのかを原子レベルで詳細に明らかにしました。複雑な構造を持つD-アラビナンを研究するためには、これらの酵素はとても役に立つものであり、今後は結核菌やその近縁のらい菌などの病原菌の「鎧」になっている細胞壁の研究が大いに進むことが期待できます。
発表内容
結核菌とその近縁のらい菌は抗酸菌と呼ばれており、重篤な病気を引き起こす病原菌ですが、細胞の周囲を覆う壁(細胞壁)の特徴のひとつとして、リポアラビノマンナン(LAM)およびアラビノガラクタン(AG)と呼ばれる非常に複雑な複合糖質(注1)が含まれています。LAMとAGの中心部分には、D-アラビノースと呼ばれる糖が枝分れや様々な結合方法で最大31個も連なった、極めて複雑な多糖(D-アラビナン)が存在します(図1)。宿主の免疫システムに認識されるLAMは、結核菌に対する宿主の免疫応答に寄与する重要な分子であることが分かっています。LAMやAGの特徴的な部分であるD-アラビナンを分解する酵素は、1971年に大阪大学歯学部の小谷尚三教授らが初めて見つけて報告しましたが、その後50年以上もの間、D-アラビナン分解酵素の正体は謎に包まれたままでした。鹿児島大学の藤田清貴准教授らは、小谷教授らが用いた土壌細菌M-2株(注2)の培養液の中からD-アラビナン分解酵素を分離・精製して、その遺伝子の同定に成功しました(注3)。まず、M-2株の菌体の外に分泌されて、D-アラビナンのほとんどを占めるα-結合を中ほどから切断する酵素が2種類発見されました(EndoMA1とEndoMA2)。さらに、それらの遺伝子の近くには、分解したD-アラビナンの断片を菌体の中に取り込み、さらに小さく分解して細菌のエネルギー源にするための酵素の遺伝子がいくつも見つかりました。ExoMA1はα-結合を端から切断する酵素であり、ExoMA2はD-アラビナンの一番外側の部分に存在するβ-結合を端から切断する酵素であることが分かりました。これら4種類の酵素は共同作業により複雑なD-アラビナンをひとつひとつのD-アラビノース分子に分解することができます。
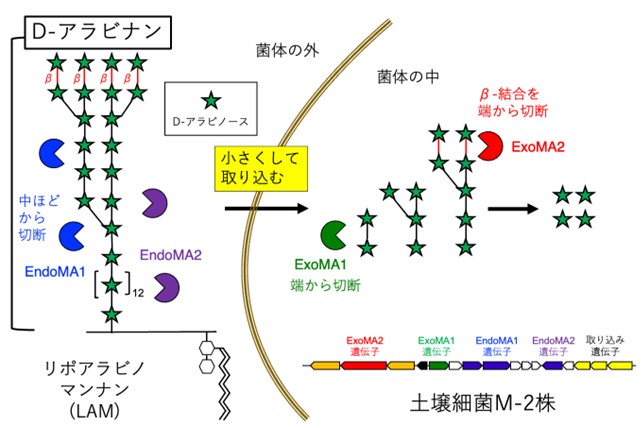
図1 M-2株のD-アラビナン分解酵素
M-2株はEndoMA1とEndoMA2の2種類の酵素を菌体の外に分泌して、D-アラビナンを切断した後に、菌体の中にその断片を取り込み、菌体の中のExoMA1やExoMA2でさらに小さく分解する。M-2株はこれらの酵素の遺伝子を並べて持っている。M-2株のD-アラビナン分解酵素は結核菌のアラビノガラクタンも分解できるが、リポアラビノマンナン(LAM)を例として示した。実際の結核菌のLAMはさらに複雑だが、ここでは簡略化して示している。
東京大学大学院農学生命科学研究科の鹿島騰真助教、福島陸大学院学生、赤井元気大学院学生、伏信進矢教授らのグループは、藤田清貴准教授、理化学研究所の石渡明弘専任研究員、高エネルギー加速器研究機構の清水伸隆教授らと共同研究を行い、X線結晶構造解析(注4)、X線小角散乱(注5)、透過型電子顕微鏡(注6)などの複数の手法を組み合わせて、D-アラビナン分解酵素の立体的な構造と作用メカニズムを詳細に明らかにすることに成功しました。EndoMA1のX線結晶構造解析からは、この酵素がどのようにD-アラビナンを結合して中ほどから切断するのかというメカニズムが原子レベルで詳細に分かりました(図2)。また、X線小角散乱による分析から、水溶液中では2つのEndoMA1分子が集まって存在することが明らかになりました。ExoMA1は以前に同グループが発見した口腔内ビフィズス菌のカラメル分解酵素と似た構造をしていましたが、12個の分子が集まって、全体ではテトラポッドのようなかたちをしていることが分かりました。ExoMA2の全体的な構造はβ-グルコシダーゼという別の酵素に似ていましたが、その活性部位(注7)は、D-アラビナンのβ-結合をしっかりと認識して結合、切断できるようなかたちをしていることが明らかになりました。
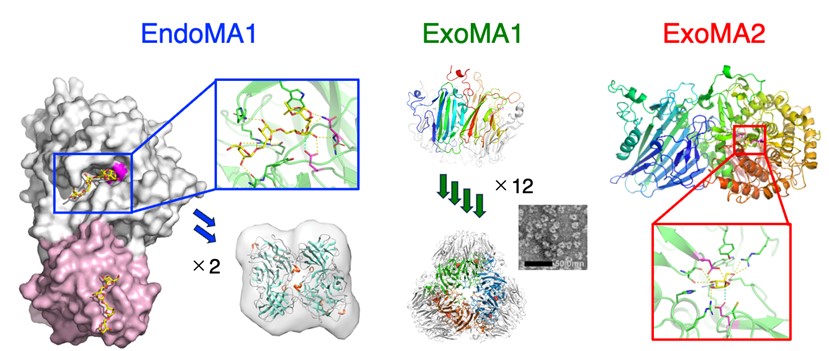
図2 D-アラビナン分解酵素の立体構造
EndoMA1:分子表面にD-アラビナン断片が結合した様子(左)。ピンク色で示した部分はD-アラビナン断片を結合するのみで切断できないが、白い部分には切断するための触媒基が存在する(右上)。右下にX線小角散乱で得られた二量体構造を示す。
ExoMA1:1つのユニットが12個集まってテトラポッドのような集合体になる。透過型電子顕微鏡でも同様の形状が観察された。
ExoMA2:D-アラビナンのβ-結合を認識して切断できるかたちが明らかになった。
LAMやAGは極めて複雑な複合分子であり、D-アラビナンに様々な化学修飾が起こっているだけでなく、その両側に広がる部分も、さまざまな糖鎖や脂肪酸、細胞壁成分などが結合しており、その全貌はいまだに明らかになっていません。本研究により見つかった酵素はD-アラビナンのどの部分をどのようにして切断するかが明確に分かっているため、結核菌の細胞壁を分解して分析する上で強力なツールになります。結核菌の細胞壁において、LAMは一番外側に、AGはその中央に存在しており、層状の鎧のようにこの病原菌を守っています。LAMとAGの中心的な部分であるD-アラビナンの分解酵素はやっかいな病原菌からどのように人々を守るかという研究にも役立つと期待されます。
発表者
下川 倫子 (鹿児島大学農学部 研究員;当時)
石渡 明弘 (国立研究開発法人理化学研究所 専任研究員)
鹿島 騰真 (東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
中島 千穂 (東京大学大学院農学生命科学研究科応用生命工学専攻 大学院学生;当時)
李 家漫 (東京大学大学院農学生命科学研究科応用生命工学専攻 大学院学生;当時)
福島 陸 (東京大学大学院農学生命科学研究科応用生命工学専攻 大学院学生)
澤井 未視 (鹿児島大学農学部 大学院学生;当時)
中森 美紅 (鹿児島大学農学部 学部学生;当時)
田中 悠暉 (鹿児島大学農学部 学部学生;当時)
工藤 亜津紗(鹿児島大学農学部 学部学生;当時)
森上 紗衣 (鹿児島大学農学部 学部学生;当時)
岩永 菜央 (鹿児島大学農学部 大学院学生)
赤井 元気 (東京大学大学院農学生命科学研究科応用生命工学専攻 大学院学生)
清水 伸隆 (高エネルギー加速器研究機構 教授)
荒川 孝俊 (東京理科大学薬学部 助教)
山田 千早 (明治大学農学部 専任講師)
北原 兼文 (鹿児島大学農学部 教授)
田中 克典 (国立研究開発法人理化学研究所 主任研究員)
伊藤 幸成 (大阪大学理学研究科 特任教授)
藤田 清貴 (鹿児島大学農学部 准教授)
伏信 進矢 (東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
発表雑誌
- 雑誌
- Nature Communications (掲載日:2023年9月19日)
- 題名
- Identification and characterization of endo-α-, exo-α-, and exo-β-D-arabinofuranosidases degrading lipoarabinomannan and arabinogalactan of mycobacteria
- 著者
- Michiko Shimokawa#, Akihiro Ishiwata#, Toma Kashima#, Chiho Nakashima, Jiaman Li, Riku Fukushima, Naomi Sawai, Miku Nakamori, Yuuki Tanaka, Azusa Kudo, Sae Morikami, Nao Iwanaga, Genki Akai, Nobutaka Shimizu, Takatoshi Arakawa, Chihaya Yamada, Kanefumi Kitahara, Katsunori Tanaka, Yukishige Ito, Shinya Fushinobu*, and Kiyotaka Fujita* (#筆頭著者、*責任著者)
- DOI
- 10.1038/s41467-023-41431-2
- URL
- https://www.nature.com/articles/s41467-023-41431-2
用語解説
- 注1 複合糖質
タンパク質、ペプチド、脂質、その他の化合物と共有結合している糖質。 - 注2 M-2株
小谷教授らが分離したD-アラビナン分解酵素を分泌する土壌細菌。現在の正式名称ではMicrobacterium arabinogalactanolyticum JCM 9171株だが、ここでは当初の名称のM-2株と呼ぶ。 - 注3 酵素の遺伝子の同定
酵素はタンパク質であり、DNAからなる遺伝子にその設計図(アミノ酸配列)が書き込まれている。様々なタンパク質の混合物である細菌の培養上清から目的のタンパク質(酵素)をクロマトグラフィー法などにより分離して、どのようなアミノ酸配列からなりたっているかを明らかにすることにより、その酵素の遺伝子を特定(同定)することが可能になる。 - 注4 X線結晶構造解析
酵素などのタンパク質の立体構造を明らかにするための最も一般的な解析方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることができる。 - 注5 X線小角散乱
タンパク質の溶液にX線ビームを照射して、低角度の散乱強度から分子のおおよそのかたちを知ることができる。結晶の中に閉じ込められた構造ではなく、水溶液中での構造を知ることができるのがメリットの一つ。 - 注6 透過型電子顕微鏡
Transmission Electron Microscope (TEM)とも呼ばれる。電子顕微鏡の一種であり、電子線を試料に照射して、試料を透過した電子の線の強弱から、投影拡大像を観察できる。 - 注7 活性部位
酵素が基質(化学反応を触媒される物質)を結合して触媒する部位。鍵と鍵穴のように基質をぴったりと結合する性質があり、化学反応を起こす触媒基も存在する。
問い合わせ先
東京大学大学院農学生命科学研究科応用生命工学専攻 酵素学研究室
教授 伏信 進矢(ふしのぶ しんや)
Tel:03-5841-5151
Fax:03-5841-5151
研究室URL:http://enzyme13.bt.a.u-tokyo.ac.jp/

