腸管バリアを強化する脂質を発見
発表のポイント
- 食物を消化吸収する腸管には、食物抗原や細菌毒素などが体内へ侵入することを防ぐバリア機能が備わっています。このバリアを強化することは、食物アレルギーや炎症性腸疾患をはじめとする様々な疾患の治療に繋がることが期待されています。
- 私たちは生体内でも産生される脂質のひとつであるプロスタグランジンD2のシグナルを薬を用いて刺激すると、腸管バリアが強化されることを発見しました。また、このメカニズムとして、粘液産生細胞である杯細胞からのムチン放出の促進が関与していることが分かりました。
- プロスタグランジンD2のシグナルの増強は、腸管バリア機能の低下に起因する様々な疾患の治療に応用できる可能性があります。
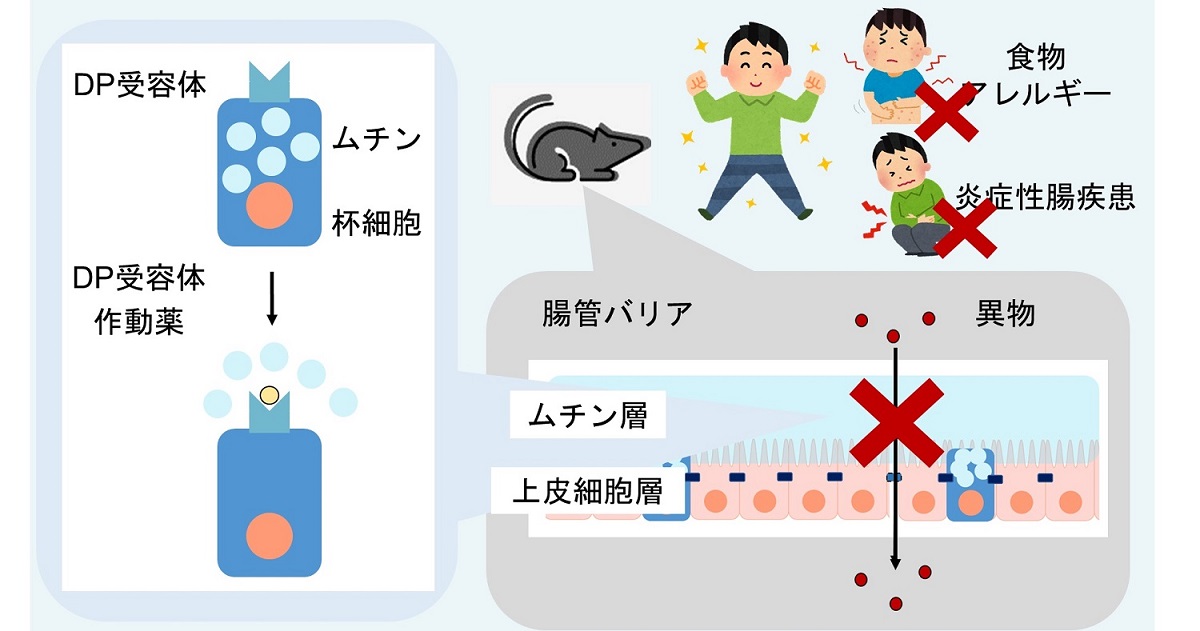
図1:研究概略図
DP受容体の作動薬は、杯細胞からのムチン放出を促進することで腸管バリアを強化します。
これは、腸管バリア機能の低下に起因する様々な疾患の治療に応用できる可能性があります。
発表内容
研究背景
食物を消化吸収する器官である腸管には、食物抗原や細菌毒素などが体内へ侵入することを防ぐバリア機能が備わっています。このバリアは主に、タイトジャンクション(注1)で強固に結合した一層の腸管上皮細胞と、その上を覆うムチン層(注2)によって形成されています。腸管バリアが破綻した状態は「リーキーガット(注3)」と呼ばれます。この状態では、食物抗原が吸収されやすくなるため、食物アレルギー反応を起こしやすくなり、また細菌毒素の侵入から炎症性腸疾患などの疾患が引き起こされやすくなります。そのため、これらのリーキーガットに起因する疾患を予防・治療することを目的に、腸管バリアを強化する方法の開発が求められています。
プロスタグランジンD2(注4)は、細胞膜由来の脂肪酸が酵素によって代謝・産生される脂質のひとつです。我々はこれまでに、プロスタグランジンD2の受容体のひとつであるDP受容体のシグナルを薬物を用いて刺激することで、食物アレルギーや炎症性腸疾患の症状を改善できることを発見してきました(引用1,2)。過去の研究では、その機構のひとつとしてDP受容体のシグナル刺激が腸管組織への免疫細胞の浸潤を抑制していることを示してきました(引用1,2)。一方で、DP受容体のシグナルが腸管のバリア機能に与える影響はわかっていませんでした。今回の研究では、DP受容体のシグナルの刺激が腸管のバリア機能に与える影響とその機構の解明を行うことを目的として実験を行いました。
方法と結果
マウスに蛍光標識されたデキストランを経口投与し、腸管から吸収された蛍光標識デキストランの血中濃度を測定することで腸管透過性を評価しました。DP受容体の作動薬を腹腔内へ投与すると腸管透過性が低下し、腸管バリアが増強されることがわかりました。摘出した腸管を用いた実験でも同様に、DP受容体の刺激が腸管バリアを強化して、色素の漏出を防ぐという結果が得られました。免疫染色を行ったところ、DP受容体はマウスの腸管上皮細胞に発現していることが分かりました。
つづいて、DP受容体の刺激が腸管バリアを亢進させるメカニズムを検討しました。ヒト腸管上皮細胞株であるCaco-2を用いてタイトジャンクションの結合強度を評価したところ、DP受容体の作動薬はこれを変化させませんでした。そこで、ムチン層の形成に着目することにしました。ムチン層は腸管上皮細胞のひとつである杯細胞(注5)が産生するムチンによって構成されています。マウス腸管の組織切片中のムチンを染色して観察すると、DP受容体の薬物による刺激は杯細胞内から腸管管腔内へのムチンの放出を促進することが分かりました。
最後に、DP受容体の刺激によるムチンの放出が腸管バリアに与える影響を評価しました。摘出した腸管を用いた実験において、ムチン層を除去すると、腸管の透過性が亢進することがわかりました。またこのとき、DP受容体の刺激による腸管透過性の抑制効果は解除されていました。このことから、DP受容体の刺激による腸管透過性の抑制にムチン層が必要であることがわかりました。
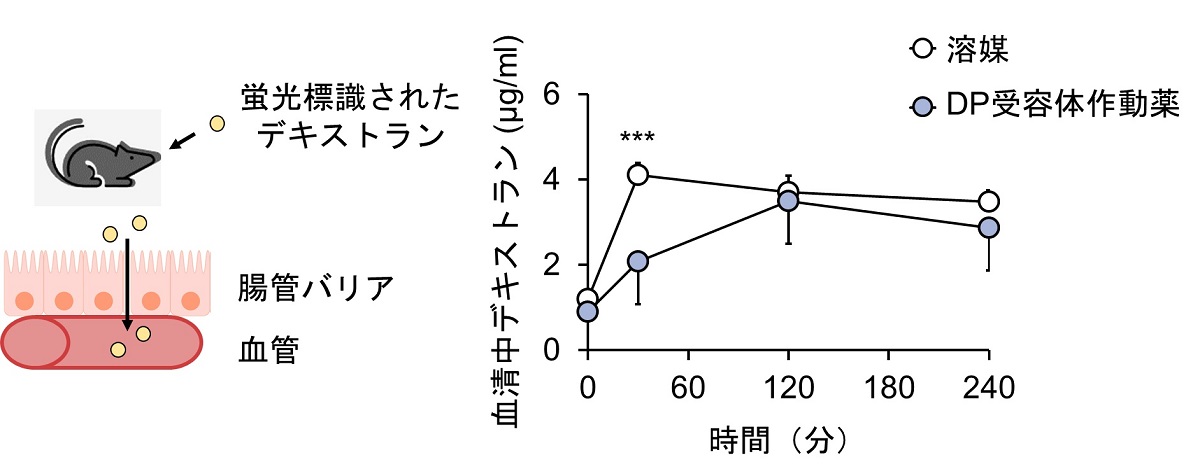
図2:DP受容体作動薬は腸管透過性を抑制する
マウスに蛍光標識されたデキストランを経口投与し、その血中濃度を測定することで腸管透過性を評価しました。
DP受容体の作動薬を腹腔内投与すると腸管透過性が低下し、腸管バリアが増強されることがわかりました。
結論
以上の結果から、薬物によるDP受容体の刺激は、杯細胞からのムチン放出を促進することで腸管バリアを強化することがわかりました。DP受容体の作動薬は、腸管バリア機能の低下に起因する様々な疾患の治療に応用できる可能性があります。
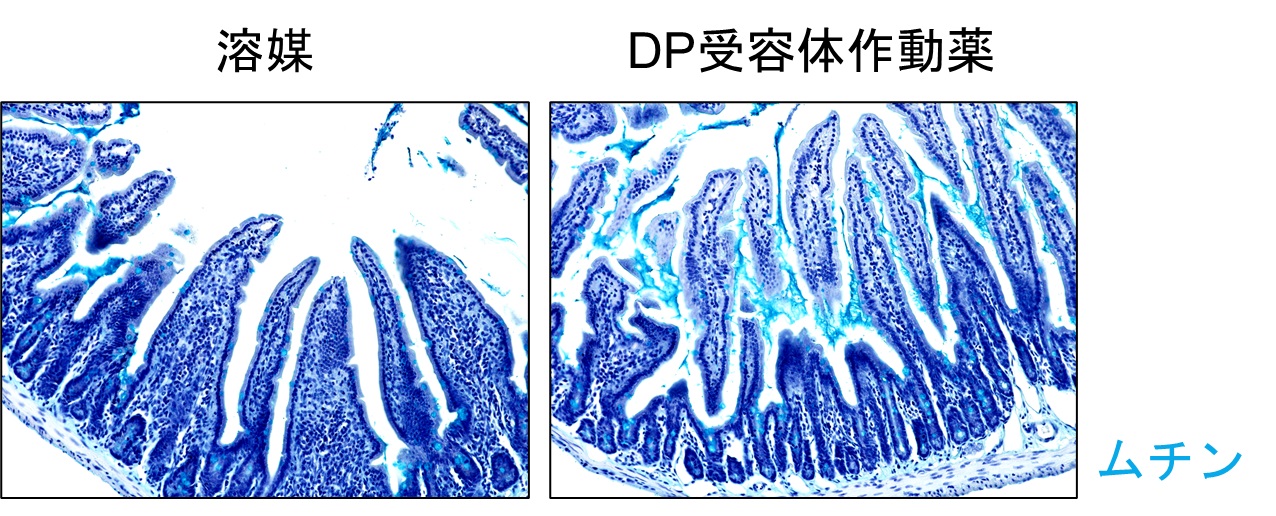
図3:DP受容体作動薬はムチン放出を促進する
マウスにDP受容体の作動薬を腹腔内投与すると、青色で示されたムチンの放出が促進されることがわかりました。
発表者
東京大学大学院農学生命科学研究科
林 亜佳音(獣医学専攻 特任研究員)
坂本 直樹(獣医学専攻 博士課程学生)
小林 幸司(食と動物のシステム学 特任講師)
村田 幸久(獣医学専攻 准教授)
発表雑誌
- 雑誌
- Frontiers in Immunology
- 題名
- Enhancement of prostaglandin D2-D prostanoid 1 signaling reduces intestinal permeability by stimulating mucus secretion
- 著者
- Akane Hayashi, Naoki Sakamoto, Koji Kobayashi, and Takahisa Murata
- DOI
- 10.3389/fimmu.2023.1276852
- URL
- https://www.frontiersin.org/articles/10.3389/fimmu.2023.1276852/full
引用文献
引用1:Nakamura T, Hirai R, Tachibana Y, Masuko S, Nagata N, Murata T, Therapeutic potential of D prostanoid receptor 1 signal enhancement in a murine model of food allergy. JACI, 2019 Jun;143(6):2290-2293. doi: 10.1016/j.jaci.2019.01.039
引用2:Iwanaga K, Nakamura T, maeda S, Aritake K, Hori M, Urade Y, Ozaki H, Murata T, Mast Cell–Derived Prostaglandin D2 Inhibits Colitis and Colitis-Associated Colon Cancer in Mice. Cancer res, 2014 June; 74(11):3011-3019. doi: 10.1158/0008-5472.CAN-13-2792
用語解説
- 注1 タイトジャンクション
上皮細胞間の隙間を埋める接着構造。細胞間の物質の透過を制限している。 - 注2 ムチン層
腸管上皮細胞の上を覆う層で、管腔内の物質と上皮細胞の接触を物理的に防いでいる。杯細胞から放出されたムチンを主成分とする。 - 注3 リーキーガット
腸管のバリア機能が低下して腸管の透過性が亢進した状態。食物抗原や細菌毒素などの体内への移行が促進されることで、食物アレルギーや炎症性腸疾患をはじめとした様々な疾患の発症・増悪因子となることがわかってきている。 - 注4 プロスタグランジンD2
細胞膜のアラキドン酸から合成される脂質メディエーターのひとつ。過去の研究で、食物アレルギーや炎症性腸疾患において炎症抑制的に働くことが示されている。 - 注5 杯細胞
腸管上皮細胞の一種で、ムチンを産生することで腸管のバリア機能を維持している。
問い合わせ先
東京大学大学院農学生命科学研究科 獣医学専攻 獣医薬理学研究室
准教授 村田 幸久(むらた たかひさ)
Tel:03-5841-7247 or 03-5841-5934
Fax:03-5841-8183
E-mail:amurata<アット>g.ecc.u-tokyo.ac.jp <アット>を@に変えてください。

