DNAと翻訳後修飾タンパク質を認識する二重交差性抗体の分子構造
- 発表者
- 阿南優佑(東京大学大学院農学生命科学研究科 応用生命化学専攻 大学院生、当時)
板倉正典(東京大学大学院農学生命科学研究科 応用生命化学専攻 助教、当時)
下田達也(東京大学大学院農学生命科学研究科 応用生命化学専攻 大学院生)
山口公輔(東京大学大学院農学生命科学研究科 応用生命化学専攻 大学院生)
陸 鵬(東京大学大学院農学生命科学研究科 応用生命化学専攻 助教、当時)
永田宏次(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
董 金華(中国康復大学 教授)
上田 宏(東京工業大学科学技術創生研究院 化学生命科学研究所 教授)
内田浩二(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授、AEMD-CREST研究者 兼任)
発表のポイント
- ◆どのような成果を出したのか
抗DNA抗体が翻訳後修飾(ピロール化)タンパク質を認識するメカニズムとして、抗体の重鎖可変領域(VH)がピロール化タンパク質中のピロールリジンと複数の酸性アミノ酸を含むペプチド配列を静電相互作用により認識していることを明らかにした。 - ◆新規性(何が新しいのか)
抗DNA抗体由来のVHでもDNA/ピロール化タンパク質と結合することを発見した。またVHとピロール化タンパク質の結合には、VH相補性決定領域(HCDR)のArg残基と、ピロール化タンパク質中のピロールリジンと酸性アミノ酸が必要であることを明らかにした。 - ◆社会的意義/将来の展望
抗DNA抗体が非核酸分子であるピロール化タンパク質を認識するメカニズムを抗体工学的な手法を用いて明らかにし、新たな抗DNA抗体研究のプラットフォームを確立した。今後は、抗DNA抗体の抗原結合阻害などによる全身性エリテマトーデス(SLE)治療への応用が期待される。
発表概要
自己免疫疾患の一種である全身性エリテマトーデス(SLE)では抗DNA抗体の異常産生が見られる。当研究室では、こうした抗DNA抗体が翻訳後修飾タンパク質であるピロール化タンパク質にも特異性を示すことを明らかにしている。これまで抗DNA抗体が非核酸分子であるピロール化タンパク質を認識するメカニズムは不明であった。
本研究では、ファージディスプレイ法を用いてピロール化タンパク質を認識する抗体フラグメントを複数作製し、抗体重鎖可変領域(VH)が抗原認識を担うことを発見した。特に抗原と結合する領域である相補性決定領域(CDR)に存在するArg残基の重要性を示した。また、VHが認識するピロール化タンパク質中の構造として、ピロールリジンと酸性アミノ酸を複数含むペプチド配列を同定した。これらの結果から、正に帯電した抗DNA抗体のVHが、負に帯電したピロール化タンパク質と静電的に相互作用していることが明らかとなった。
発表内容
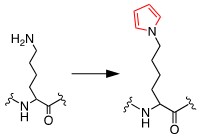
図1 リジン残基のピロール化
図2 二重交差性フラグメント抗体の結晶化
A: フラグメント抗体のイメージ(左)と 実際のフラグメント抗体結晶構造のリボンモデル(右)。 B: フラグメント抗体の三次元表面モデル。
研究背景と内容
抗DNA抗体は自己免疫疾患の一種であるSLEにおいて異常産生される自己抗体であり、病態や診断の重要なバイオマーカーである。抗DNA抗体はDNAやRNAなどの核酸以外の分子と相互作用することが報告されており、我々はこれまでにその一つとしてピロール化タンパク質を発見している。ピロール化タンパク質は内因性の酸化脂質によりタンパク質が修飾を受けることで生成され、生体内でもその存在が確認されている(図1)。このようにピロール化タンパク質とSLEの関係性が示唆される一方で、抗DNA抗体がピロール化タンパク質を認識するメカニズムは不明であった。
本研究では、ファージディスプレイ法を用いてSLEモデルマウス脾細胞からDNAを認識する一本鎖抗体フラグメントを複数作製した。これらのフラグメントを用いた解析により、抗DNA抗体はVH単体でもDNA/ピロール化タンパク質の両方の抗原と結合することが明らかとなった(図1)。抗体の抗原結合にはCDRが重要であるが、VHのCDRにおいてArg残基が多数存在していた。これらのArg残基に変異を導入したVH変異体では、DNA/ピロール化タンパク質に対する親和性が顕著に減少した。以上の結果から、抗DNA抗体は正に帯電したVHによってDNA/ピロール化タンパク質両方の抗原を認識していることが明らかとなった。
続いて、ピロール化タンパク質を酵素消化によりペプチド断片化し、VHと結合するペプチドを探索した。その結果、ピロールリジンと酸性アミノ酸を複数含むペプチド配列が同定された。このピロール化ペプチドの酸性アミノ酸に変異を導入すると、VHとの結合が抑制された。また、抗原結合ドメインからなるフラグメント抗体のX線結晶構造解析を行ったところ、正に帯電したVHのCDR3領域(HCDR3)が抗体表面に露出していた(図2)。さらに、このVHとピロール化ペプチドのドッキングシミュレーションを行ったところ、VHのArg残基とペプチドの酸性アミノ酸の結合への関与が示唆された。
以上の結果から、ピロール化タンパク質は塩基性アミノ酸であるリジン残基がピロール化されることにより表面電荷が負に帯電し、VHと静電相互作用で結合していることが示唆された。
この研究は、独立行政法人日本学術振興会科学研究費補助金 基盤研究(S)、AMED革新的先端研究開発支援事業 AMED-CRESTの支援を受けて行われました。
発表雑誌
- 雑誌名
- Communications Biology
- 論文タイトル
- Molecular and structural basis of anti-DNA antibody specificity for pyrrolated proteins
- 著者
- Yusuke Anan, Masanori Itakura, Tatsuya Shimoda, Kosuke Yamaguchi, Peng Lu, Koji Nagata, Jinhua Dong, Hiroshi Ueda, and Koji Uchida
- DOI番号
- 10.1038/s42003-024-05851-0
- 論文URL
- https://www.nature.com/articles/s42003-024-05851-0
問い合わせ先
東京大学大学院農学生命科学研究科応用生命化学専攻 食糧化学研究室
教授 内田 浩二(うちだ こうじ)Tel:03-5841-5127 Fax:03-5841-8026
E-mail:a-uchida<アット>g.ecc.u-tokyo.ac.jp
<アット>を@に変えてください。
研究室URL:http://park.itc.u-tokyo.ac.jp/foodchem/index.html
関連教員
内田 浩二
永田 宏次

