6種類の機能を持つD-アミノ酸代謝酵素を初期の生命から発見
発表者
- 宮本 哲也 (北里大学薬学部分析化学教室 講師)
- 新田 峻平 (東京大学大学院農学生命科学研究科応用生命工学専攻 大学院学生;当時)
- 本間 浩 (北里大学 名誉教授)
- 伏信 進矢 (東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
研究成果のポイント
- 初期の生命である超好熱菌のアミノ酸代謝酵素TM1270の機能を詳しく調べて、その立体構造から反応メカニズムを明らかにしました。
- TM1270は異なる6種類の化学反応を触媒してD-アミノ酸とL-アミノ酸の両方を代謝できるという、前例のない多機能型酵素であることが分かりました。
- 細菌が自らの生存に必要なD-アミノ酸をどのように合成しているのかを詳しく調べることで、病原菌の増殖を抑える技術の開発などに役立つと期待できます。
研究概要
全ての生命はもっぱらL型のアミノ酸を利用していますが、鏡像異性体のD型アミノ酸も多くの生命現象に関わっており、特に細菌の生存に重要であることが分かってきています。細菌は様々なD-アミノ酸合成酵素を持つ事が知られていますが、それらに関する知見は、いまだに不十分です。北里大学薬学部の宮本哲也講師の研究グループは、共通の祖先に近い生物である超好熱菌から、D-アミノ酸とL-アミノ酸の両方を幅広く代謝できるアミノ酸代謝酵素TM1270を発見して、6種類もの異なる触媒活性を有する、これまで知られていないほどの多機能を持つ酵素であることを明らかにしました。東京大学大学院農学生命科学研究科の伏信進矢教授らの研究グループは、宮本講師のグループと共同研究を行い、TM1270の立体構造をX線結晶構造解析により解明して、その複雑な触媒機能における原子レベルの化学反応のメカニズムを推定することに成功しました。D-アミノ酸は細菌の細胞壁や抗生物質の成分であるだけでなく、腸内細菌が作るD-アミノ酸が腸内細菌叢や自然免疫応答に影響を与えることも知られています。細菌がD-アミノ酸を代謝・生合成する酵素を詳しく調べることにより、病原菌の増殖を抑えたり、共生細菌がヒトなどの宿主の健康や病態に与える影響を制御する技術の開発にもつながると期待されます。
研究内容
アミノ酸には、L型とその鏡像異性体であるD型が存在します。生命は基本的にL-アミノ酸のみを使ってタンパク質を作りますが、分析技術の発展によりD-アミノ酸も様々な生物種に存在していることが確認されたことで、各生物にD-アミノ酸を積極的に利用するシステムが備わっていると考えられています。細菌において、D-アミノ酸は細胞壁(注1)や抗生物質の構成成分に利用されています。哺乳類ではD-アミノ酸を合成する酵素は一つしか知られていませんが、細菌は様々なD-アミノ酸を合成する酵素を有しており、それらの酵素によって細胞壁の合成に必要なD-アミノ酸を作っています。細胞壁のD-アミノ酸を合成する酵素は薬剤のターゲットとなり、近年では、細菌のバイオフィルム(注2)をD-アミノ酸が解体することや、腸内細菌が合成するD-アミノ酸が宿主の病態や健康に影響を与えることが明らかとなり、医学・薬学的観点からも注目されています。しかしながら、多種多様な細菌に存在する多様なD-アミノ酸代謝酵素に関する知見はいまだに不十分です。
北里大学薬学部の宮本哲也講師と北里大学の本間浩名誉教授は、海底の熱水地帯から得られた超好熱菌Thermotoga maritima(注3、以下T. maritima)を対象にD-アミノ酸代謝酵素を探索しました。T. maritimaなどの超好熱菌は全ての生物の共通の祖先に近いため、原始生命が持っていた多機能性の酵素を多く保持していることが知られています(本研究科プレスリリース2011年10月11日 https://www.a.u-tokyo.ac.jp/topics/2011/20111011-1.html)。宮本哲也講師らは、T. maritimaのTM1270という酵素に注目しており、これまでの研究で、この酵素が細胞壁の構成成分の一つであるD-グルタミン酸の合成に寄与していることを明らかにしています。今回、TM1270がその他のアミノ酸でどのような触媒反応を行うのか、幅広く調べたところ、①ラセマーゼ活性、②βC-Sリアーゼ活性、③デヒドラターゼ活性、④アルドラーゼ活性、⑤デカルボキシラーゼ活性、⑥アミノトランスフェラーゼ活性という6種類の化学反応を、いずれも高い効率で触媒することを発見しました(表1)。

図1 TM1270が有する6種類の機能
これらの触媒反応はEC番号(注4)による分類においても別々の番号にあたる、全く異なる化学反応です。①ラセマーゼ活性とは、L-アミノ酸とD-アミノ酸を相互に変換する活性、すなわち、L-アミノ酸からD-アミノ酸を合成する活性です。TM1270は、14種類のアミノ酸に対してラセマーゼ活性を示し、その中で、グルタミン酸に対して最も活性が高いことが明らかになりました。これは、TM1270が細胞壁のD-グルタミン酸の合成に寄与しているという、過去の研究に合致した結果です。②βC-Sリアーゼ活性とは、システインなどに含まれる炭素-硫黄結合を切断してピルビン酸などに分解する反応です。TM1270は、L型とD型両方のシステインとL-シスタチオニンを分解する活性を有することを明らかにしました。③デヒドラターゼ活性とは、セリンなどヒドロキシ基(-OH)を含むアミノ酸をピルビン酸などに分解する反応です。TM1270は、L型とD型の両方のセリン及びL-allo-スレオニン(注5)に対してデヒドラターゼ活性を示すことが明らかとなりました。④アルドラーゼ活性とは、炭素-炭素結合を切断する反応で、例えば、スレオニンをグリシンとアセトアルデヒドに分解する活性です。TM1270は、L-スレオニンとL-allo-スレオニンに対してアルドラーゼ活性を示すことがわかりました。⑤デカルボキシラーゼ活性とは、カルボキシ基(-COOH)を持つアミノ酸に対して作用し、二酸化炭素を脱離する反応です。TM1270は、L-アスパラギン酸を分解してL-アラニンにする活性を有することを明らかにしました。⑥アミノトランスフェラーゼ活性は、アミノ酸のアミノ基(-NH2)を2-オキソ酸へと転移して、別のアミノ酸を合成する反応です。TM1270は、16種類のL-アミノ酸および7種類の2-オキソ酸に対してアミノトランスフェラーゼ活性を示すことが明らかになりました。以上の解析結果から、TM1270は非常に多くのD-アミノ酸及びL-アミノ酸を代謝することができる、前例のない多機能なアミノ酸代謝酵素であることが明らかとなりました。
東京大学大学院農学生命科学研究科の新田峻平大学院学生と伏信進矢教授は、宮本哲也講師らのグループと共同研究を行い、X線結晶構造解析(注6)により、TM1270の三次元構造を1.7 Åという高い分解能で明らかにしました(図2)。TM1270は4量体であり、分子内にピリドキサールリン酸(注7)という化合物が結合していました。このピリドキサールリン酸は、TM1270の202番目のリジン(K202)というアミノ酸に直接結合しており、6種類の多様な反応を触媒するのに欠かせない補酵素です。さらに、TM1270と他の生物が持つ類似酵素の活性部位の立体構造を比較して、K202とピリドキサールリン酸の周囲に存在するアミノ酸残基を別の種類のアミノ酸に置換した変異体酵素を解析することにより、他にもその多機能性で重要な役割を担うアミノ酸残基を決定しました。以上の研究結果を総合することで、TM1270がどのように化学反応を起こして6種類もの酵素活性を生み出すのかという原子レベルの反応機構を推定することに成功しました。
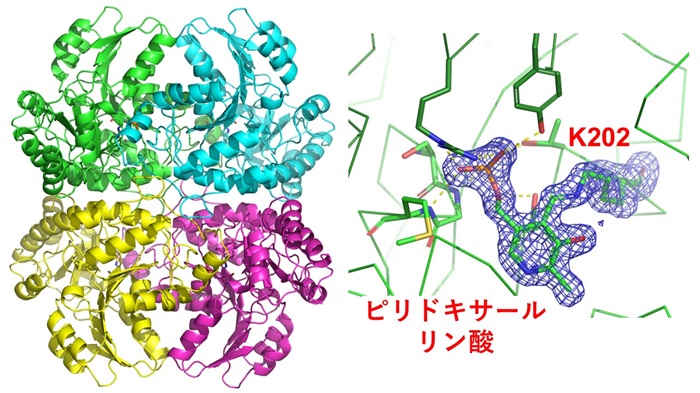
図2 TM1270の立体構造。
四量体の構造(左)と活性部位の構造(右)。活性部位に結合したピリドキサールリン酸と、202番目のリジン(K202)の電子密度マップを青色のカゴで示している。
本研究により、原始生物に近い超好熱菌が、これまでに知られていないほどの多種類の触媒活性を示す酵素を持つことが明らかになり、生命の進化においてアミノ酸代謝酵素がどのように分子進化してきたのかという命題に新たな実験事実が加わりました。また、現在でも各種生物におけるD-アミノ酸の代謝経路の多くはブラックボックスになっています。例えば、哺乳類においてD-アスパラギン酸は内分泌系のホルモン分泌や合成に関わる重要な分子ですが、その生合成経路は不明なままです。本研究の対象となったT. maritima においても、細胞壁に欠かせない構成成分であるD-アラニンの生合成経路は明らかになっていません。本研究などに基づくと、多機能型アミノ酸代謝酵素が未知のD-アミノ酸代謝を紐解く鍵であると考えています。したがって、新たな多機能型アミノ酸代謝酵素の発見が未知のD-アミノ酸代謝経路の発見に繋がっているものと考えられます。一方で、病原菌が細胞壁のD-アミノ酸を合成する酵素は薬剤のターゲットとなっており、D-アミノ酸が感染の足がかりとなるバイオフィルムを解体すること、腸内細菌が合成するD-アミノ酸が宿主の病態や健康に影響を与えることなども次々と明らかになっています。本研究成果は医学・薬学的観点からも、重要な基礎研究であるといえます。
論文情報
- 雑誌
- ACS Catalysis(掲載日:2024年12月11日)
- 題名
- Functional and structural analyses of a highly multifunctional enzyme TM1270 from the hyperthermophile Thermotoga maritima
- 著者
- Tetsuya Miyamoto*, Shunpei Nitta, Hiroshi Homma, and Shinya Fushinobu* ( *責任著者)
- DOI
- 10.1021/acscatal.4c05275
- URL
- https://pubs.acs.org/doi/abstract/10.1021/acscatal.4c05275
用語解説
- 注1 細菌の細胞壁
細菌の代表的な細胞壁の成分はペプチドグリカンであり、N-アセチルグルコサミンとN-アセチルムラミン酸の2種類の糖が交互に繋がった主となる鎖が、ペプチド鎖によって架橋されている。このペプチドには通常、D-アラニンとD-グルタミン酸の2種類のD-アミノ酸が含まれている。T. maritimaのペプチドグリカンにおいては、これら2種類のD-アミノ酸に加えて、D-リジンが含まれている。 - 注2 バイオフィルム
微生物や微生物が生産する物質(多糖類、タンパク質、DNAなど)が集まってできた構造体の総称。増殖した微生物が固体表面に固着するために必要な構造体であり、病原菌においては宿主の体内で感染するために必要となることがある。D-アミノ酸は、細菌のバイオフィルムの形成を阻害したり、解体を促進することが明らかとなっている。 - 注3 Thermotoga maritima (T. maritima)
イタリア付近の海底の熱水地帯より発見された、80℃で最も良く生育し、最高で90℃の環境でも生育できる、嫌気性の(酸素がある環境を嫌う 超好熱性の細菌である。標準的な系統解析に基づくと、共通の祖先に近い生命のひとつとして知られている。 - 注4 EC番号
国際生化学分子生物学連合(IUBMB)の酵素委員会(Enzyme Commission)により、1960年代より始められた、酵素をそれが触媒する化学反応によって分類するシステムであり、4つの数字を並べることにより個別の酵素を一連の番号で表す。例えば、最初の数字は大分類であり、EC 2は転移酵素、EC 4は脱離酵素、EC 5は異性化酵素であることを示す。2番目と3番目の数字はさらに細かい反応の分類を示し、4番目の数字は個別の酵素に割り振られる。グルタミン酸ラセマーゼのEC番号は5.1.1.3となっている。本研究に関わった伏信進矢教授は2022年から本委員会に加入しており、新規なEC番号の割り振りや修正の業務の一部を担当している。 - 注5 L-allo-スレオニン
スレオニンは、2箇所の光学活性中心を有していることから、4種類の異性体が存在している。すなわち、L-スレオニン、D-スレオニン、L-allo-スレオニン、D-allo-スレオニンである。TM1270のアルドラーゼ活性はL-スレオニンとL-allo-スレオニンの両方に高い効率を示すため、低特異性のスレオニンアルドラーゼとしてEC 4.1.2.48に相当する。 - 注6 X線結晶構造解析
酵素などのタンパク質の立体構造を明らかにするための一般的な解析方法。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることができる。 - 注7 ピリドキサールリン酸
ビタミンB6の活性型の化合物であり、酵素内のリジン残基と結合して触媒反応を助ける、いわゆる補酵素として作用する。
問い合わせ先
東京大学大学院農学生命科学研究科応用生命工学専攻
酵素学研究室 教授 伏信 進矢(ふしのぶ しんや)
Fax:03-5841-5151
研究室URL:http://enzyme13.bt.a.u-tokyo.ac.jp/

