飼い殺し型寄生の鍵となる寄生蜂毒遺伝子の同定に成功
研究概要
キイロショウジョウバエを宿主とする寄生蜂ニホンアソバラコマユバチの巧みな生存戦略を支える毒遺伝子の同定に成功しました。この毒遺伝子から作られるタンパク質は、ハエが成虫になるために必要な成虫組織を殺すことで、宿主個体は生かしたまま宿主体内のハチの成長を助け、寄生を成功に導きます。
寄生蜂とは、主に昆虫やクモの栄養を一方的に奪って生活するハチ目の昆虫です。寄生蜂の種類は膨大であり、現在の地球上で最も繁栄している生物である昆虫類約100万種の中の約20%を占めるとも推定され、地球上で最も成功した戦略を持つ動物群の一つです。この繁栄とユニークな生活戦略ゆえに、古くから多くの学者たちが、寄生蜂がどのようにして己の宿主の体を乗っ取って貪り尽くしてしまうのかを問う研究に取り組んできました。しかし、個体の小ささや飼育の困難さのため、寄生を支える分子機構には未だ不明な点が多く残されています。
本研究グループは、モデル生物であるキイロショウジョウバエを宿主とする寄生蜂ニホンアソバラコマユバチの飼い殺し型寄生に着目し、毒遺伝子IDDF(成虫原基縮退因子)の同定に成功しました。IDDFは、宿主ハエ幼虫体内の成虫原基(将来の成虫組織)を選択的に縮退させるのに必須です。宿主ハエを幼虫からサナギまで生かしつつ成虫になるのを防ぐ(飼い殺す)ことで、ハチの寄生を成功に導きます。
本研究成果は、寄生蜂の巧みな生存戦略の分子機構の一端を明らかにするとともに、寄生蜂毒が新しい生物毒の候補として研究対象となる可能性を見いだしたものです。今後、さまざまな昆虫を標的とする寄生蜂毒の作用メカニズムを調べることで、農薬や天然医薬資源のシーズとして活用できると期待されます。
研究内容
研究の背景
寄生蜂とは、宿主である他種昆虫やクモ等の節足動物の栄養やエネルギーを利用して生活するハチ目昆虫の総称です。寄生蜂は宿主の体の内外に卵を産みつけ、孵化したハチの幼虫は成長し、宿主を食べて成虫へと成長します。このような独特の生活スタイルを持つ寄生蜂の種数は、現在の地球上で繁栄している昆虫類の約20%にも及ぶと推定されており、地球上で最も成功した戦略を持つ動物群の一つといっても過言ではありません。このような寄生蜂の巧みな生存戦略を分子レベルで解明することは、生物間相互作用の仕組みを理解する上で重要です。
寄生蜂たちの繁栄を支える基盤の一つは、寄生蜂が産生する「毒」にあると考えられています。特に、内部寄生蜂というグループは、産卵(感染)時に宿主に毒のカクテルを注入することで、麻酔をかけたり、免疫組織を攻撃したり、神経系に作用する等して、子ハチの成長と寄生の成立を助けます。進化の過程において、さまざまな寄生蜂が己の宿主を攻略するための多種多様な毒カクテルを獲得してきました。しかしながら、寄生蜂毒の実態とその作用メカニズムが解明されている例は非常に限定的です。
本研究チームはこれまでに、寄生の分子メカニズムを理解するため、遺伝学的解析に優れたキイロショウジョウバエ Drosophila melanogasterを宿主とする寄生蜂ニホンアソバラコマユバチAsobara japonicaの全ゲノム配列を解読し、遺伝子ノックダウン手法(特定の遺伝子の機能を抑制させる技術)の開発を行ってきました(Kamiyama et al., DNA Research 29(4), dsac019, 2022)。これらのリソースを活用し、今回、ニホンアソバラコマユバチの毒の作用を解析し、毒遺伝子の同定を行いました。
研究内容と成果
ニホンアソバラコマユバチ(以下、ハチ)は、キイロショウジョウバエ(以下、ショウジョウバエまたはハエ)に寄生し、その幼虫体内に卵一つと毒カクテルを注入します(図1)。ショウジョウバエ幼虫は一時的に麻酔にかかって動けなくなりますが、すぐに回復して何事もなかったかのようにそのまま成長します。一方、そのハエ幼虫体内ではハチの卵が孵化して、宿主と共にスクスク成長します。そして、ショウジョウバエがサナギになった殻の内部でショウジョウバエを捕食し、最終的に、ショウジョウバエのサナギ1個からハチ1匹が羽化します。このような「飼い殺し型寄生」を助ける毒カクテルは、宿主に対して即効性の殺傷効果がない一方、成長を妨げない形で、じわりじわりと宿主の体を蝕んでいきます。
完全変態昆虫(卵→幼虫→サナギ→成虫という変態様式を持つ昆虫)であるショウジョウバエの幼虫体内には、将来の成虫の翅や眼になるために不可欠な上皮組織/成虫原基 (imaginal discs)が存在しています。本研究では、感染後の宿主ハエ幼虫体内において成虫原基が顕著に縮退することを発見し、この現象を「成虫原基縮退 (Imaginal disc degradation, IDD)」と名付けました。詳しく調べたところ、ハチに感染したショウジョウバエの成虫原基の細胞では、細胞死(アポトーシス)と細胞内のタンパク質分解システム(オートファジー)が誘導され、また細胞分裂が停止していました。興味深いことに、成虫原基は著しく縮退する一方で、同じ幼虫体内の脳神経系や筋肉、脱皮と変態に必要な内分泌器官、脂肪組織には変化が認められませんでした(図1)。これらの器官は、成虫原基とは異なり、幼虫の行動や発育に必須の器官であり、ハチ感染後も宿主幼虫が発育を続けてサナギになることと一致しています。すなわち、ハチの毒カクテルには、ハチにとって必要ない組織(成虫原基)だけを選択的に殺してしまう活性があることが強く示唆されました。
そこで、宿主ハエ成虫原基での細胞死誘導に必要な毒成分を特定するために、ニホンアソバラコマユバチの全ゲノム配列を解読し、毒成分に関連する12,508遺伝子を予測しました。これらについて、トランスクリプトーム解析注1)とプロテオミクス解析注2)を行い、毒成分を産生する器官である毒腺で高発現する195遺伝子を選びました。そして、IDDを生じない別の寄生蜂種との遺伝子の保存性を解析し、63の遺伝子をIDD関連遺伝子候補として同定しました。
これら63の毒遺伝子の機能を調べるために、ハチでの遺伝子ノックダウン法を開発し、個々の標的遺伝子の機能を抑制したハチを作り出しました。そして、それらの寄生蜂を用いて感染実験を行い、宿主に細胞死を誘導できなくなるかどうかを調べたところ、63の候補遺伝子のうち、二つの毒遺伝子をそれぞれノックダウンすることによって、ハチ感染による細胞死、オートファジー、細胞分裂の停止がいずれも起こらなくなることを見いだしました。細胞死が抑制された結果、IDDが顕著に抑制されていたことから、この二つの毒遺伝子が IDD 誘導に必須の遺伝子であることが明らかになり、これらを Imaginal disc degradation factor (成虫原基縮退因子、IDDF) と名付けました。また、同定された二つのIDDF(IDDF-1とIDDF-2)は、どちらも新規の分泌タンパク質をコードしている(特定のタンパク質を作るための塩基配列を持つ)ことが分かりました(図2)。
さらに、この二つのいずれかのIDDF遺伝子の発現を抑制した寄生蜂の寄生成功率は、正常な寄生蜂に比べて減少しました。すなわち、IDDFの産生をハチの体内で抑制すると、宿主体内でハチが成長できず、ショウジョウバエが寄生に打ち勝つ割合が上昇します。このことは、ハチの毒に含まれるIDDFによる宿主の成虫原基の縮退が、ハチの寄生成功を支える重要な生命現象である可能性を支持します。
今後の展開
本研究により、寄生蜂の毒遺伝子を同定し、飼い殺し型寄生の分子機構の一端が初めて明らかになりました。今後、毒タンパク質の作用メカニズムを解明することで、アポトーシスとオートファジー、細胞分裂の停止が組織選択的に誘導されるメカニズムを明らかにしていきます。また、今回同定された二つの毒遺伝子のみならず、毒腺に存在する他の毒分子の機能にも着目し、寄生成立を助ける毒カクテル成分全てを明らかにすることを目指します。さらに、寄生蜂近縁種間で毒遺伝子セットを比較することにより、どの宿主に対して寄生を成立させることができるのかという宿主選択性の分子メカニズムの解明に挑戦していきます。これら一連の研究は、基礎生物学的な知識にとどまらず、特定害虫に対する農薬のシーズや、組織特異的に作用する薬剤の開発等に新たな知見を提供できるプラットフォームになることが期待されます。
参考図
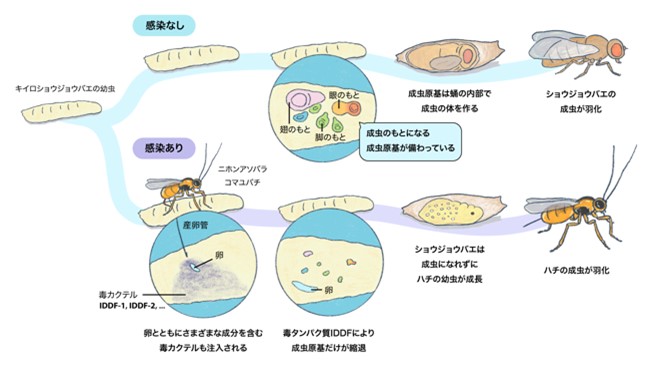
図1:宿主ショウジョウバエのライフサイクル [感染なし]と、内部寄生蜂ニホンアソバラコマユバチのライフサイクル [感染あり]
上段(感染なし):ショウジョウバエ幼虫の体内には将来の成虫の体のもととなる組織(成虫原基)が存在している。幼虫がサナギになった後で、サナギ内部で変態が起こり、成虫の体が作られる。
下段(感染あり):ニホンアソバラコマユバチはショウジョウバエの幼虫に産卵管を突き立てて、卵と毒カクテルを注入する。毒カクテルに含まれるIDDFの働きにより、成虫原基が縮退する。一方、成虫原基以外の組織はそのまま残っているので、宿主は成長し続けてサナギになることができる。ハチ幼虫は宿主体内で成長し、宿主がサナギになった後で殺して食べ、ハチ成虫が羽化する。
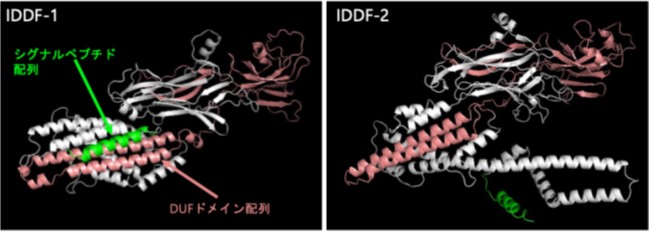
図2:毒タンパク質IDDF-1 と IDDF-2の予想構造
Alphafold2(タンパク質の構造を予測するAIプログラム)を用いて予測したニホンアソバラコマユバチの毒タンパク質IDDFの構造。緑の部分がアミノ末端に存在するシグナルペプチド配列注3)部位で、ピンクの部分が機能未知のドメイン構造(DUF4803: Domain of unknown function 4803)を表している。
発表者
筑波大学 生存ダイナミクス研究センター
島田 裕子 准教授
丹羽 隆介 教授
高エネルギー加速器研究機構 物質構造科学研究所
千田 俊哉 教授
東京大学 大学院農学生命科学研究科
勝間 進 教授
論文情報
- 雑誌
- Science Advances
- 題名
- Parasitoid wasp venoms degrade Drosophila imaginal discs for successful parasitism
(寄生蜂の毒が寄生成功のためにショウジョウバエの成虫原基を縮退させる) - 著者
- Kamiyama, Takumi(上山 拓己、筑波大学生存ダイナミクス研究センター、助教)
Shimada-Niwa, Yuko(島田-丹羽 裕子、同上、准教授)
Mori, Hitoha(森 一葉、筑波大学生物学学位プログラム博士前期課程(当時))
Tani, Naoki(谷 直紀、熊本大学発生医学研究所、研究員)
Takemata-Kawabata, Hitomi(竹股-川端 ひとみ、筑波大学生命環境科学研究科博士前期課程(当時))
Fujii, Mitsuki(藤井 美月、同上(当時))
Takasu, Akira(高巣 晃、高エネルギー加速器研究機構 物質構造科学研究所、研究員(当時))
Katayama, Minami(片山 南美、筑波大学生命環境科学研究科博士前期課程(当時))
Kuwabara, Takayoshi(桑原 嵩佳、筑波大学生命環境学群生物学類(当時))
Seike, Kazuki(清家 和樹、筑波大学生命環境科学研究科博士前期課程(当時))
Matsuda-Imai, Noriko(松田-今井 典子、東京大学大学院農学生命科学研究科、特任研究員)
Senda, Toshiya(千田 俊哉、高エネルギー加速器研究機構 物質構造科学研究所、教授)
Katsuma, Susumu(勝間 進、東京大学大学院農学生命科学研究科、教授)
Nakamura, Akira(中村 輝、熊本大学発生医学研究所、教授)
Niwa, Ryusuke(丹羽 隆介、筑波大学生存ダイナミクス研究センター、教授) - DOI
- 10.1126/sciadv.adq8771
研究助成
本研究は、日本学術振興会科学研究費助成事業 基盤研究(C)「内部寄生蜂が宿主ショウジョウバエ幼虫に誘導する組織特異的細胞死シグナル経路の解析」(18K05670)、同 若手研究「寄生蜂の寄生成立の可否を決定づける分子基盤の解明」 (23K13960)、同 特別研究員奨励費「寄生蜂の飼い殺し型寄生を司る組織選択的アポトーシス誘導因子の同定と作用機序の解明」(21J10894)、文部科学省科学研究費助成事業 学術変革領域研究(A)計画研究「飼い殺し型寄生蜂の毒による巧みな発生操作の分子基盤」(24H02297)、科学技術振興機構(JST) 創発的研究支援事業「寄生蜂毒研究に基づく上皮選択的な細胞死誘導の解明」(JPMJFR2263)、同 さきがけ「宿主内環境を支配する寄生蜂由来生体微粒子の機能解析」(JPMJPR19H6)、大隅基礎科学創成財団研究助成(2022~2025年度)の支援により実施されました。
用語解説
- 注1)トランスクリプトーム解析
ある生物個体、組織、または細胞内に蓄積するRNAを網羅的に収集し、遺伝子の発現を測定・分析する方法。 - 注2)プロテオミクス解析
ある生物個体、組織、または細胞内に存在するタンパク質を網羅的に解析する手法。 - 注3)シグナルペプチド配列
タンパク質分子に含まれる短いペプチド配列で、タンパク質の輸送先や局在化を支持する構造。
問い合わせ先
丹羽 隆介(にわ りゅうすけ)
筑波大学 生存ダイナミクス研究センター 教授
URL: https://sites.google.com/view/niwa-lab-tsukuba
【取材・報道に関すること】
筑波大学 広報局
TEL: 029-853-2040
E-mail: kohositu[at]un.tsukuba.ac.jp
高エネルギー加速器研究機構 広報室
TEL: 029-879-6047
E-mail: press[at]kek.jp
東京大学大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)
TEL: 03-5841-8179, 5484
E-mail:koho.a[at]gs.mail.u-tokyo.ac.jp
科学技術振興機構 広報課
TEL: 03-5214-8404
E-mail: jstkoho[at]jst.go.jp
【JST事業に関すること】
加藤 豪(かとう ごう)
科学技術振興機構 創発的研究推進部
E-mail: souhatsu-inquiry[at]jst.go.jp
※上記の[at]は@に置き換えてください。

