脳を低酸素ストレスから保護する薬剤の開発 ――脳梗塞や低酸素脳症による傷害の軽減に貢献――
発表のポイント
- 痛風治療薬として広く使用されているフェブキソスタットは、低酸素ストレス下におけるマウス脳内のATP枯渇を軽減しました。
- 同じく痛風治療薬であるアロプリノールと比較して、フェブキソスタットの方が顕著な効果を示すことが明らかとなりました。
- 脳梗塞や低酸素脳症などによる脳機能障害を低減する新たな治療法創出への貢献が期待されます。
研究概要
東京大学大学院農学生命科学研究科の岡本研特任研究員、佐藤奈々技術補佐員、永田宏次教授、日本医科大学の草野輝男助教らによる研究グループは、痛風治療薬として使われている薬剤が脳を低酸素傷害から保護することを明らかにしました。
循環器不全や呼吸不全、低酸素環境などによって脳への酸素供給が滞ると、脳機能は速やかに損傷されます。この脳損傷にはアデノシン三リン酸(ATP)の枯渇が関与しています。痛風治療薬アロプリノール(注1)は、低酸素脳傷害に対する保護効果があることが報告されていますが、その作用機序は明らかになっていませんでした。また、別の痛風治療薬フェブキソスタット(注2)にも脳保護作用があるかについては、十分に研究されていませんでした。
本研究では、低酸素条件におかれたマウスの脳内ATPおよびその代謝物濃度変化を正確に測定することで、上記薬剤の影響を明らかにしました。脳が低酸素状態に置かれるとATPの分解が始まりますが、フェブキソスタットを投与した場合、対照群より高いATPレベルが保たれ、ATP分解生成物は低く維持されました。この結果は、フェブキソスタットが低酸素による脳内のATP分解を軽減させたことを示しています。またアロプリノール群と比較すると、尿酸低下作用は同程度であるにもかかわらず、フェブキソスタットの方が高い保護効果を示しました。本研究は、血管閉塞や低酸素による損傷から脳機能を保護する治療法の発展に寄与し、脳梗塞後遺症の改善剤や低酸素脳症治療薬の開発につながります。
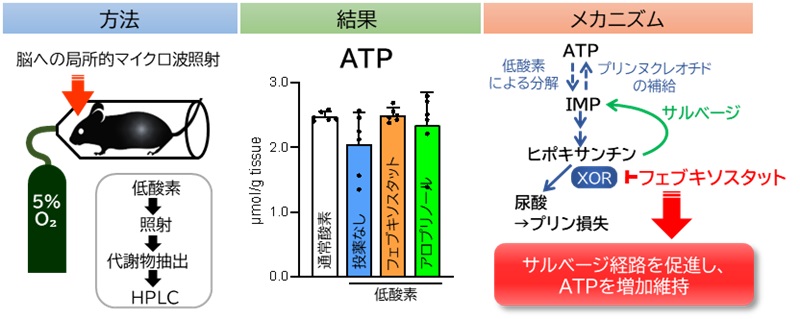
図1:本研究の概要
(方法)低酸素状態を維持したジャケット内でマウスの脳へマイクロ波を照射し、代謝を停止させた後、脳から代謝物を抽出し定量した。(結果)低酸素処置による脳内ATP低下がフェブキソスタットによって軽減された。(メカニズム)フェブキソスタットはヒポキサンチンから尿酸への分解を阻害することで、ヒポキサンチンからATP前駆体を合成するサルベージ経路を強化する。
研究内容
<背景>
ATPの分解物であるヒポキサンチンは、サルベージ経路(注3)によって再びプリンヌクレオチド(イノシン一リン酸, IMP:注4)へ戻り、ATP合成に寄与できます。しかし、キサンチン酸化還元酵素(XOR:注5)によってヒポキサンチンがキサンチン、さらに尿酸へと分解されると、サルベージされることなく、排泄されてしまいます(図2-1)。痛風治療薬であるアロプリノールとフェブキソスタットはXORを阻害することで尿酸生成を抑制し、体内のヒポキサンチンを高めます。
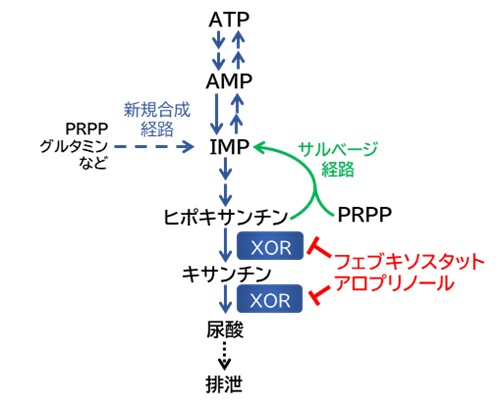
図2-1:XORが関与するATPの合成と分解経路
フェブキソスタットとアロプリノールは、XORによるヒポキサンチン→キサンチン→尿酸の分解反応を阻害する。
略語:ATP, アデノシン三リン酸; AMP, アデノシン一リン酸; IMP, イノシン一リン酸; PRPP,ホスホリボシル二リン酸; XOR, キサンチン酸化還元酵素
。
<研究の成果>
我々は、低酸素を維持したままマイクロ波を照射することで脳の代謝を瞬時に停止させ、ATPおよびその代謝物を測定する手法を開発しました(図1)。この手法により、従来は困難であった低酸素による脳内ATP代謝変化を正確に捉えることに成功しました。
5%の低酸素条件に3分間置かれたマウスの脳では、ATPレベルが低下し、ATP分解物であるAMPや尿酸が増加していました(図2-2)。フェブキソスタットを投与したマウスでは、低酸素条件下でも高いATPレベルが維持され、AMPレベルも低いままでした。したがって、フェブキソスタットが低酸素によるATP分解を軽減させたことが示されてします。アロプリノールを投与した場合、フェブキソスタットほど顕著な効果は見られませんでした。尿酸生成阻害効果については両薬剤に差がなかった点を併せて考察すると、XOR阻害剤によるATP維持効果のメカニズムには尿酸は直接関与していないと考えられました。
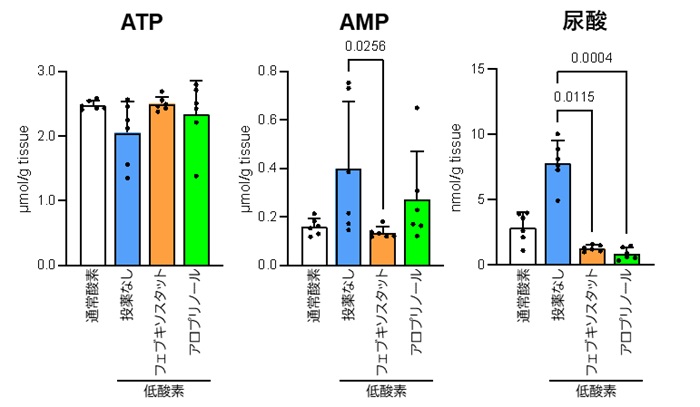
フェブキソスタット、アロプリノールは処置の30分前に投薬した(それぞれ、5 mg/kg、10 mg/kg)。統計的有意差はDunn’s法で検定し、0.05未満のp値を図に示した。棒グラフは平均値、エラーバーは標準偏差、点は個々の値を表す(n=6)。
略語:ATP, アデノシン三リン酸; AMP, アデノシン一リン酸
<メカニズム>
低酸素ストレスによってATP分解が進むと、ヒポキサンチンが増加します(図2-3)。ヒポキサンチンは血中に移動し、肝臓に豊富なXORによって尿酸へと変換されます。プリン体は尿酸になってしまうと、もうATPへ戻ることができないため、体内のATP合成材料が減少していきます。その結果、脳内のATP濃度も減少します。一方、薬剤によってXORを阻害すると、肝臓でヒポキサンチンは尿酸に変化せず血中に放出され、脳に取り込まれると考えられます。脳はサルベージ経路が発達しているため、ヒポキサンチンは積極的にATPへ再合成され、ATP維持に寄与します。これが、XOR阻害剤による脳のATP維持効果のメカニズムと考えられます(図2-3)。
アプリノールは、ヒポキサンチンとよく似た化学構造であるため、サルベージ経路内の酵素を阻害することが知られています。このため、本研究ではフェブキソスタットとアロプリノールの効果に差が見られたのだと考えられます。

<今後の展望>
XOR阻害剤によってATPサルベージ経路の強化する戦略は、血流障害や呼吸障害による脳損傷の治療だけでなく、神経変性疾患やエネルギー枯渇に起因する疾患の治療法へ応用できる可能性があります。本研究で用いた薬剤は既に医薬品として長い臨床経験があり、安全性が確認されているため、本剤を用いた新たな治療法が早期に生み出されると期待されます。
〇関連情報:
プレスリリース①「尿酸値と神経変性疾患発症リスクとの関連を明らかに ――ヒトの脳におけるプリンサルベージ経路の重要性の証明及びその増強による新たな進行防止戦略――」(2024/7/29)
https://www.a.u-tokyo.ac.jp/topics/topics_20240729-1.html
発表者
東京大学大学院農学生命科学研究科
岡本 研 特任研究員(責任著者)
佐藤 奈々 技術補佐員(筆頭著者)
永田 宏次 教授
日本医科大学医学部
草野 輝男 助教
論文情報
- 雑誌
- Brain Research
- 題名
- A non-purine inhibitor of xanthine oxidoreductase mitigates adenosine triphosphate degradation under hypoxic conditions in mouse brain
- 著者
- Nana Sato, Teruo Kusano, Koji Nagata, Ken Okamoto
- DOI
- 10.1016/j.brainres.2025.149444
- URL
- https://www.sciencedirect.com/science/article/pii/S0006899325000022
用語解説
- 注1)アロプリノール:
痛風の原因となる尿酸生成を抑制する治療薬。プリン塩基(ヒポキサンチン、アデニン、グアニン、キサンチン、尿酸など)とよく似た化学構造を持つ。特にヒポキサンチンと類似性が高い。 - 注2)フェブキソスタット:
アロプリノールと異なり、プリン類似構造を持たない尿酸生成阻害薬。アロプリノールよりも低用量で尿酸値低下効果を示す。 - 注3)サルベージ経路:
ヌクレオチド分解の中間産物を再利用して、ヌクレオチドを合成する経路。ここでは特に、ヒポキサンチンからIMPを合成する経路を指す。 - 注4)プリンヌクレオチド:
プリン塩基にリボースとリン酸が結合した化合物の総称。ATP、AMP、IMPはプリンヌクレオチドの一種。 - 注5)キサンチン酸化還元酵素(xanthine oxidoreductase; XOR):
プリン代謝の最終段階であるヒポキサンチンからキサンチン、キサンチンから尿酸への2反応を触媒する酵素であり、高尿酸血症・痛風治療薬の標的タンパク質である。
問い合わせ先
(研究内容については発表者にお問合せください)
東京大学大学院農学生命科学研究科
特任研究員 岡本 研(おかもと けん)
E-mail:akenokamoto[at]g.ecc.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。

