妊娠につながるマウスの精子形成ステージを自動判定するAI開発に成功――不妊症の原因となる精子形成の質の評価に貢献――
慶應義塾大学理工学部生命情報学科の徳岡雄大研究員と森倉峻特任助教、舟橋啓教授、東京医科歯科大学(現、東京科学大学)実験動物センターの遠藤墾助教(現、東京大学大学院農学生命科学研究科助教)、大阪大学微生物病研究所の平舘裕希特任助教(当時)と伊川正人教授らのグループは、深層学習を用いて、組織染色されたマウス精細管の明視野顕微鏡画像から12段階の精細管ステージを高精度に同定するアルゴリズムの開発に成功しました。
さらにステージ予測の分類精度は、±1ステージの予測誤差を許容した場合98.33%と非常に高い性能を示すことを明らかにしました。本手法は、精細管ステージを自動的かつ定量的に評価する新たな基盤技術として、生殖補助医療や不妊治療分野に貢献することが期待されます。
本研究成果は学術雑誌Scientific Reports誌Webサイトにてオンライン速報版が7月1日(英国時間)に公開されました。
本研究のポイント
◆マウス精細管を組織染色した明視野顕微鏡画像と深層学習を用いて、マウス精巣管の精子形成過程を非常に高い精度で自動的に評価することに成功した。
◆深層学習モデルは、精子形成に関する生物学的情報を一切学習していないにもかかわらず、生物学的に妥当な判断根拠に基づき精細管のステージを予測できていることを明らかにした。
◆現在、精細管ステージは熟練者が目視で評価しているが、今後は正常な精子形成の判断基準を自動的かつ客観的に行うことができるため、生殖補助医療や不妊治療分野への貢献が期待される。
研究背景
不妊症は世界的な社会問題であり、適齢期カップルの8~12%が罹患しています。症例の半数は男性要因に起因し、その大部分は精子形成障害が要因だと考えられています。異常な精子形成に関与する主要な遺伝子や環境因子の一部は同定されていますが、正常な精子形成を支配する調節メカニズムは、いまだ完全に解明されていません。
これまで、Hematoxylin-PAS染色※1によって組織学的に染色された精細管(造精組織)の明視野顕微鏡画像を用いて、精子形成過程(精細管ステージ)を目視で12段階に分類することで、精子形成のメカニズムの解明を試みてきました。一方で、ステージの正確な識別には研究者の高度な熟練を要し、人的労力や時間コストが高いため、研究者の熟練度に依存せず、客観的かつ自動的にステージを識別する手法が求められてきました。
近年、深層学習を活用して組織染色された画像の分析を自動化することで、人的労力と時間コストの高さ、および客観性の低さといった課題を克服することを目指した研究報告が相次いでいます。しかし、マウスの精細管には異なるステージの特徴が混在している場合があり、これらの特徴の多様さが精細管ステージを高精度に分類する深層学習モデルの構築を阻んでいました。そこで本研究では、画像データの幅広い特徴を学習させるアルゴリズムによって、深層学習アルゴリズムのひとつである、畳み込みニューラルネットワーク (Convolutional Neural Network, CNN)モデルを訓練することで、マウスの精子形成ステージを高精度に自動予測するフレームワークの構築を目指しました。
研究内容・成果
本研究ではまず、Hematoxylin-PAS染色された精細管の明視野顕微鏡画像1,229枚(RGB画像)に対して、それぞれ12段階の精子形成ステージを熟練者によってラベル付けした新たなデータセットを構築しました。ステージ予測を行う深層学習アルゴリズムとして、CNNを応用した残差ネットワーク(Residual Network, ResNet)や、残差ネットワークを改良したWide-ResNetやResNeXt、MobileNet等を採用し、それぞれのモデルに対してステージの分類問題を学習させました(図1a)。学習時には、精細管画像に含まれる多様な特徴をモデルに幅広く学習させるために、12段階すべてのステージが必ず学習データに含まれるように制約するミニバッチサンプリング法※2を導入し、さらに学習用画像をランダムにクロップまたは回転させるデータ拡張法※3も併用しました。
その結果、本研究で構築したすべてモデルにおいて、Balanced Accuracy※4が70%を超える高精度な分類性能を示し、予測されたステージと正しいステージの誤差のほとんどは±1の範囲内であることが分かりました。そこで、予測誤差の許容幅を±1に設定して分類精度を評価したところ、ResNetを用いた深層学習モデルの予測精度は98.33%という非常に高い精度を達成していることを明らかにしました(図1b)。
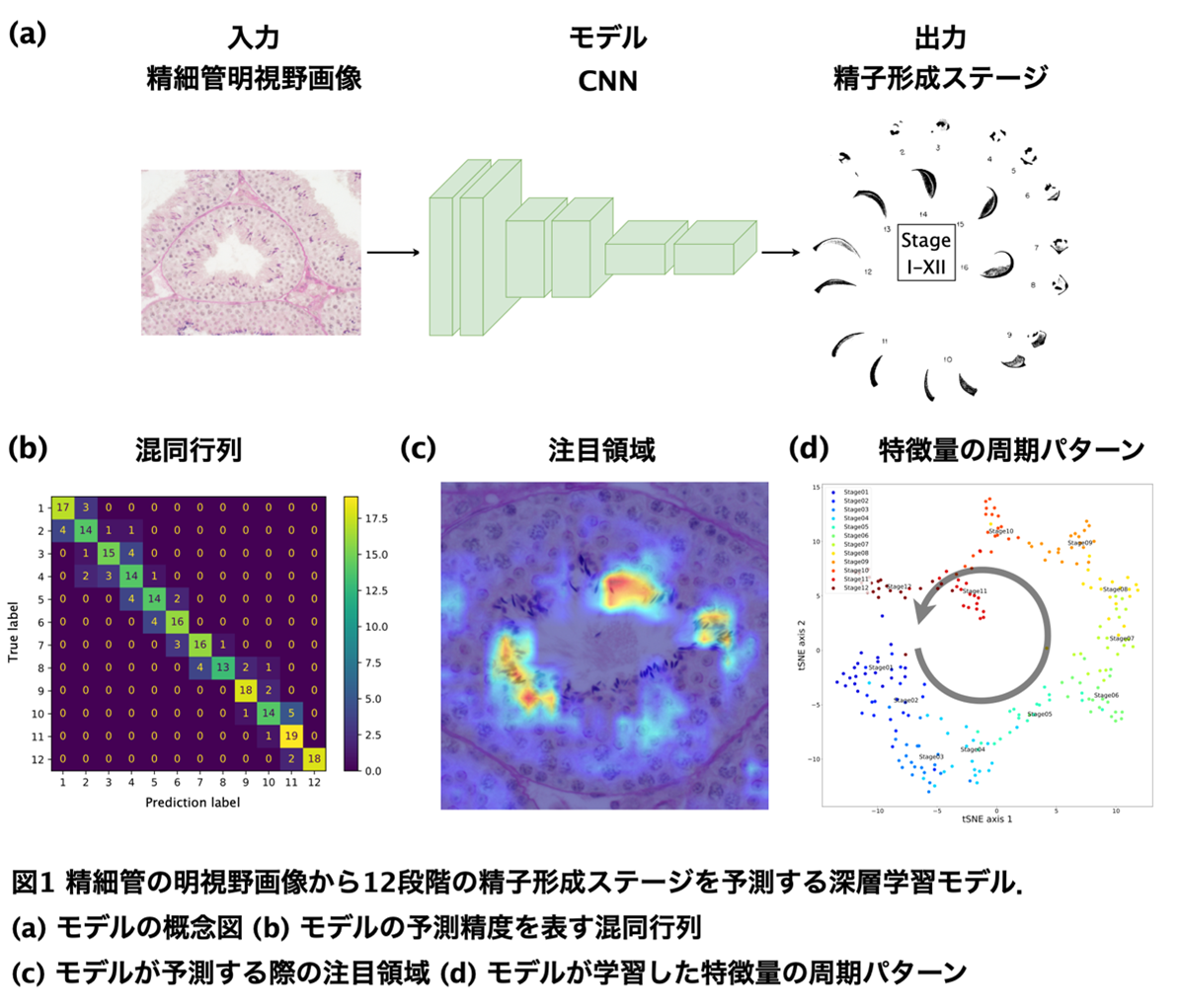
また非常に興味深いことに、研究グループが開発した深層学習モデルは、精子形成に関する生物学的情報を一切学習していないにもかかわらず、熟練者が生物学的に注目する組織構造と同様の構造に着目しながらステージを予測していることが明らかになりました(図1c)。さらに、精子形成のステージが周期的に遷移する生物学的パターンを学習していることが明らかになりました(図1d)。これらの結果から、本研究で構築した深層学習モデルは、生物学的に妥当な判断根拠を基に精子形成ステージを予測することで、極めて高い分類精度を達成したものと考えられます。
今後の展開
複雑な精子形成メカニズムの理解に向けて、精細管の高精度なステージ分類を客観的かつ自動的に行うフレームワークを構築することは極めて重要な課題でした。本研究で開発した深層学習モデルは、生物学的に妥当な判断根拠に基づいて高精度にステージを予測できるだけでなく、研究者の熟練度に依存せずに精子形成ステージを評価する客観的な基準を与えるため、生殖分野の基盤となる非常に有用なツールとなる可能性があります。
本研究では、精細管画像を精巣組織の組織切片画像から手動で抽出し、染色日の違いによる染色ムラが比較的少ない画像データを対象としました。将来的に、男性要因の不妊症に関する診断や治療への臨床応用を見据え、精子形成評価のステップを完全に自動化する方法や、染色ムラに対しても頑健な深層学習モデルの構築が極めて重要です。現在、研究グループでは、本研究で得た知見を活用し、精細管画像の抽出ステップを完全に自動化するとともに、染色ムラが発生した精細管画像も高精度にステージ分類可能な深層学習モデルの構築を進めています。これにより、迅速かつ網羅的な精子形成評価を可能にする新たなフレームワークを構築し、今後、精子形成評価の自動化によって、生殖補助医療や不妊治療分野の発展に貢献することが期待されます。
※本研究はJST CREST(JPMJCR21N1)の助成や支援を受けて行われました。
論文情報
タイトル:Deep-learning–based automated prediction of mouse seminiferous tubule stage by using bright-field microscopy
タイトル和訳:深層学習に基づく明視野顕微鏡を用いたマウス精細管段階の自動予測
著者:徳岡 雄大1,#、遠藤 墾2,3, #、森倉 峻1、平舘 裕希4、伊川 正人4,*、舟橋 啓1,*1慶應義塾大学 2東京大学 3東京医科歯科大学 4大阪大学微生物病研究所
#共同筆頭著者 *共同責任著者
掲載誌:Scientific Reports
DOI: https://doi.org/10.1038/s41598-025-06727-x
用語説明
※1 Hematoxylin-PAS染色
精細管の組織構造を可視化するための一般的な組織染色方法。ヘマトキシリンと過ヨウ素酸-シッフを用いて、精細管の構成する細胞と構造物を染め分ける。
※2 ミニバッチサンプリング法
深層学習モデルを学習させる際に、学習データを一度に全て用いてモデルを学習させるのではなく、いくつかのデータを抽出してモデルを逐次的に学習させるミニバッチ学習において、データの抽出方法を工夫する手法。
※3 データ拡張法
深層学習モデルに多様な特徴を学習させるために、学習データに対して回転や反転など様々な変換処理を施すことで、見かけ上、モデルにとって新たなデータを学習させる手法。
※4 Balanced Accuracy
各クラスに属するサンプル数を用いて、それぞれのクラスにおける予測の正答率を正規化することで、クラスごとのサンプル数の不均一さに依存しない正答率を評価するための指標。
研究内容についてのお問い合わせ先
東京大学 大学院農学生命科学研究科 助教 遠藤 墾(えんどう つとむ)
TEL:03-5841-3088 FAX:03-5841-5621 E-mail: atendo@g.ecc.u-tokyo.ac.jp

